Science、Nature发布艾滋病研究重大突破
来自Weill Cornell医学院的研究人员开发出了一些新技术,使得研究者第一次观察到了HIV病毒蛋白在病毒表面的“舞蹈”,其有可能促成了HIV感染人类免疫细胞。他们的研究发现发布在10月8日的《自然》(Nature)以及《科学》(Science)杂志上。
两篇论文的共同作者、Weill Cornell医学院生理学和生物物理学副教授Scott Blanchard博士说,这一新技术平台为开发出一种方法来预防HIV感染开辟了新的可能性。
“能够看到HIV的活动,我们可以实时追踪病毒表面蛋白的行为,从而有望告诉我们阻止HIV与人类细胞融合我们需要了解的信息,如果你能够阻止HIV病毒进入免疫细胞,那么你就赢了,”Blanchard博士说。
“我们在Science论文中展示,我们现在掌握了一种方法来获得完整HIV病毒颗粒表面上发生的过程的实时图像,我们现正计划利用其来筛查一些药物和抗体的影响。”
Blanchard博士说:“我们迫切需要一些解决方案来防止HIV感染,迄今为止,全球有超过7000万人遭受HIV感染或因此丧命。”
利用光来观看HIV舞蹈
这项Science研究是由Blanchard博士、耶鲁大学医学院HIV专家Walther Mothes博士、以及Blanchard的第一个研究生、现为塔夫茨大学医学院助理教授的James Munro博士共同合作完成。
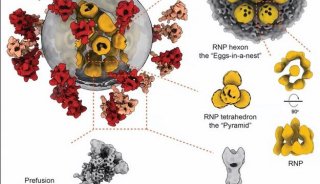
Blanchard博士采用单分子荧光共振能量转移(smFRET)成像技术研究了病毒颗粒。smFRET成像是一种利用荧光在分子尺度上测量距离的技术。他的研究小组开发出了一些他称作为“信号标”(beacon)的荧光分子(荧光团),并将这些分子插入到病毒的包膜中。将两种特异的信号标置于适当的位置,可利用smFRET成像来显像随时间推移,当病毒蛋白改变构象时分子的移动。这种方法可测量显现不同颜色的两个信号标之间大约十亿分之一英寸的距离,并可利用它在发生形状变化及附着信号标移动之时进行检测。
该研究小组利用这一技术研究了HIV病毒表面蛋白(称作为包膜蛋白)的运动,这些蛋白是病毒能够感染携带CD4受体蛋白的人类免疫细胞的关键。CD4受体蛋白帮助了HIV结合细胞。包膜蛋白是由位置紧靠的三个gp120与gp41蛋白构成的“三聚体”(trimer) ,当存在CD4时这一三聚体会像花一样开放,暴露出对至关重要的gp41亚基。
Blanchard博士说:“在每个HIV病毒颗粒的表面有20-30个这样的包膜蛋白三聚体,它们可以快速突变,由此逃避典型的免疫反应。这就是为何人类如此难以启动有效的免疫反应,也是研究人员难以开发出靶向HIV包膜蛋白的疫苗的原因。”研究人员研究了来自两种不同HIV病毒株的蛋白,其中包含的信号标不会改变病毒颗粒的生物学。
随后他们进行了观察。
他们看到包膜蛋白的形状不断地发生变化,它们运动的时间和状态既相似但又不同。Blanchard博士说:“这解答了第一个大问题:包膜蛋白三聚体是如何被触动开放的。许多科学家们认为,在偶遇CD4阳性细胞之前这些颗粒保持一种构象。但我们看到当没有CD4存在时这些蛋白也在舞动――它们一直在改变形状。”
研究人员随后观察了当导入合成CD4 时病毒的反应。他们还看到显示效应的一些抗体发挥作用阻止了gp120开放,这些效应与病毒的细胞感染能力下降有关联。当他们导入一种正在开发中用于阻止HIV感染的小分子时发生了类似的事情。
“这一技术使得我们开始了解了这一生物系统如何运动。到目前为止我们检测出了包膜蛋白三聚体三种不同的构象。我们现正致力于改良这一技术以获得生成广泛有效的治疗所需的成像精度,”Blanchard说。
在同日发表的Nature论文中,美国国家过敏和传染病研究所的研究人员利用X射线晶体学捕获了Science论文中揭示的其中一种构象的三维结构。
Blanchard博士说:“我们观察到在晶体学研究中所采用的抗体让HIV包膜蛋白停止了舞蹈,迫使这一三聚体进入一种静止的基态。”
“这一原子分辨率的有形图像显示了这一预融合机器的样子,抗体结合的部位,朝着了解HIV的生物学迈出了重要的一步。”
-
科技前沿
-
项目成果

-
项目成果
-
焦点事件