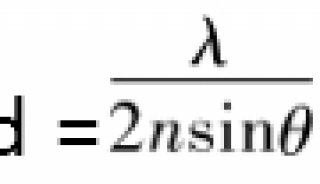徕卡超高分辨显微技术-病毒学相关研究应用(一)
引言
2020年注定是不平凡的一年,也将是载入史册的一年。一个不太热门的研究,一下子进入了公众视野,给我们上了一堂沉重的课。那么如何有效防范病毒传播,如何进行专业防控和疫苗研发,这都需要对病毒基本特征和机理深入研究。
然而,由于受到光学衍射极限的限制,普通光学显微镜分辨率只能达到200nm,而通常病毒和亚细胞结构的尺寸只有几十到200多纳米,远远小于普通光镜的分辨率。超高分辨显微技术的出现,为观测这类精细结构提供了可能,因此也得到了越来越广泛的应用。作为超高分辨技术的先驱,受激发射损耗(STimulated
Emission Depletion, STED)技术更是在生命科学领域尤其是病毒学相关研究中发挥着重要作用。
本次为大家分享STED技术在病毒学研究中的应用和新进展,助力生命科学研究和发展。
STED基本原理
2014年诺贝尔化学奖授予三位科学家,以表彰他们发明超高分辨显微技术。其中Stefan
Hell发明了STED技术,而徕卡公司也是第一个将其商业化。从2007年开始,徕卡STED产品不断创新和优化,已经拥有近13年的STED技术积累。2014年首次推出SP8
STED
3X,即荣获当年的R&D100大奖。2019年更是创新性的推出了τ-STED,进一步在提升分辨率的同时降低了激光功率,更适合活细胞超高分辨成像。
2014年诺贝尔化学奖获得者,左起分别是:Eric Betzig、Stefan W. Hell、William E. Moerner
说了这么多,STED技术原理到底是什么呢?很简单。我们想象一下,一个点发射出的荧光信号,被检测后通常是一个衍射斑;如果我们同时使用一个甜甜圈样的激光将其周围的信号擦除掉,只允许中心很小的荧光信号发射出来,这样分辨率不就提高了吗。这个起擦除作用的激光便是STED激光,也叫损耗光,利用的是荧光的受激发射损耗原理。之后,通过对图像的扫描,即可直接呈现超高分辨图像,无需任何后续计算过程。同时,根据公式,可通过增加STED激光功率来提升图像分辨率。
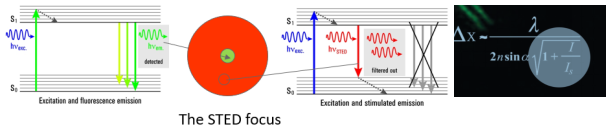 STED原理示意图:STED通过受激发射损耗去除衍射环上的荧光信号,大大缩小有效的激发区域,从而改写了分辨率公式,提高了光学分辨率
STED原理示意图:STED通过受激发射损耗去除衍射环上的荧光信号,大大缩小有效的激发区域,从而改写了分辨率公式,提高了光学分辨率
STED技术在病毒学研究中的应用实例
01
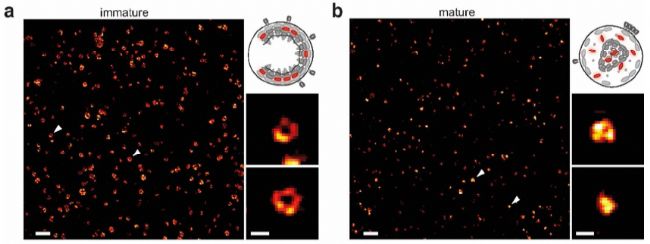
第一个应用实例,是对病毒精细结构的观察。2012年发表在国际顶级期刊science上,标题为:荧光纳米显微镜(STED)揭示成熟依赖的HIV-1病毒表面蛋白的再分布特征【1】。
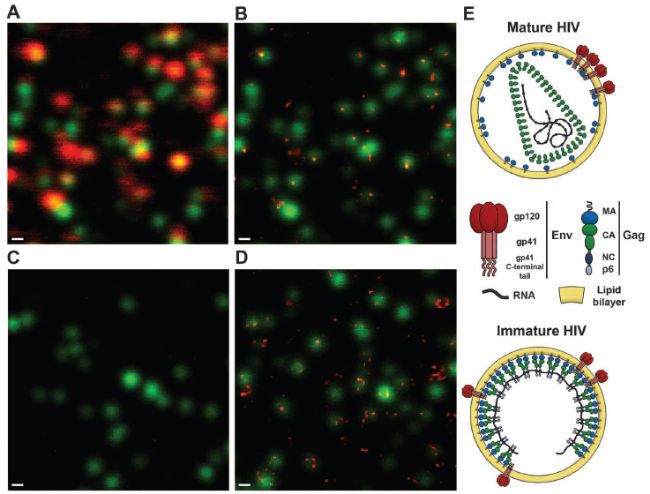
图中绿色代表HIV-1病毒粒子,红色表示病毒表面的膜蛋白。可以看到,通过普通共聚焦无法分辨膜蛋白的具体定位位置,很模糊。包膜糖蛋白gp120(红色)与病毒粒子(绿色)90%共定位,信号模糊,分辨不出细节。而STED成像可以发现,大多数成熟病毒粒子表现出单一的包膜蛋白Env信号或焦点(图1B),而大多数未成熟粒子表现出两个或两个以上的包膜蛋白Env信号(图1D)。
02
第二个应用实例,是对病毒成熟过程的观察。标题为:STED纳米显微镜揭示HIV病毒蛋白水解成熟的时间过程【2】。
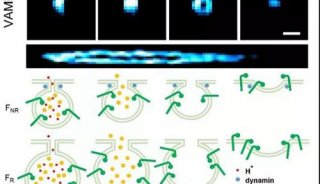
利用STED显微镜发现在HIV-1病毒成熟和未成熟条件下,可非常清晰区分其Gag蛋白的不同结构特征。未成熟病毒的Gag蛋白呈中空环状(图a),而成熟病毒中呈实心固缩状(图b)。

作者巧妙的利用光控方法,进行STED时间序列成像。在400nm紫外光照后,PDI(光催化降解的蛋白酶抑制剂)降解,Gag蛋白能够被蛋白酶水解切割,进而病毒成熟。STED时间序列成像可轻松捕获病毒从未成熟到成熟过程,Gag蛋白重排的结构变化过程。
03
第三个应用实例,是对病毒基因组示踪。标题为:以单分子分辨率示踪宿主细胞中的病毒基因组【3】。
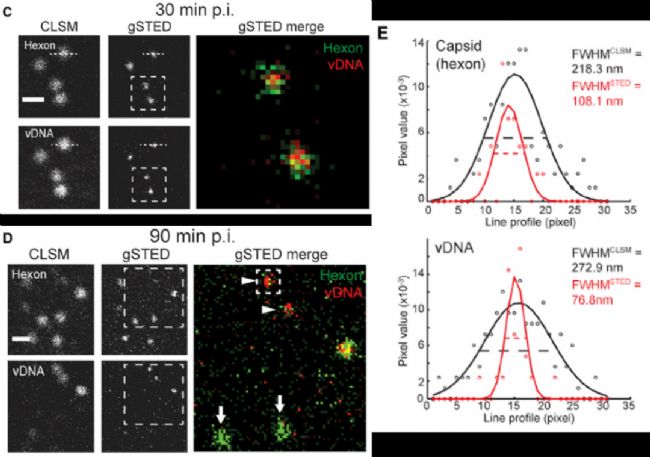
腺病毒DNA通过AF594标记的叠氮点击反应显示,衣壳蛋白通过抗hexon的抗体识别,并且只有在脱壳后,病毒DNA才可以被反应检测到荧光信号。
通过gated
STED超高分辨显微成像,可显著提高分辨率,清晰呈现病毒衣壳和DNA的真实尺寸大小。腺病毒衣壳实际大小约80nm,gSTED显示约110nm(包含一二抗尺寸),与实际一致。gSTED显示被衣壳蛋白包裹的病毒DNA尺寸略小于80nm,也与衣壳尺寸符合。
-
市场商机

-
焦点事件

-
企业风采

-
企业风采

-
产品技术

-
科技前沿
-
科技前沿

-
项目成果