推动新药专项示范性药物临床评价平台建设
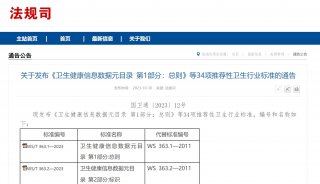
2017年10月,卫健委为落实中办、国办下发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强重大新药创制科技重大专项(以下简称新药专项)临床评价技术平台建设课题管理,充分发挥试点示范作用,推动相关政策落实落地。新药专项实施管理办公室研究于2019年1月21日发布了《新药专项示范性药物临床评价技术平台建设课题工作要求》(下简称《要求》)。

业内普遍认为,此次《要求》提出:建设新药专项示范性药物临床评价技术平台对于未来临床研究机构工作与发展方向具有极高的指导意义,有望为本土新药创制带来巨大帮助。
上海市公共卫生临床中心(下简称“上海公卫”)新药临床研究中心主任顾俊在接受记者采访时表示:“国家提出新药专项临床评价技术平台的建设,意味着国家对于新药创新重视度提高的同时,注意到了临床研究的重要性。今天这个技术平台的建设可以说是未来临床研究工作的趋势,也意味着国家在逐步与国际接轨,建立临床研究的评价标准。而这些,对于临床研究工作者来说,国家的重视会带来医院层面的重视,大家看到了政策落地的曙光,看到了行业的未来,看到了工作的价值,工作也会越做越好。
值得注意的是,《要求》中提到比如组织架构、专职人员能力和数量要求、场地要求、软硬件配备、考核晋升机制等细节的落地实施。如果按照《要求》标准严格执行,在上海能够符合要求的临床研究机构不过2、3家,甚至在全国范围内也不多,因此对于当下的绝大多数机构来说还是难以达到此标准的。
顾俊坦言:“原因简单点说,很多我们耳熟能详的大型知名医院,并不是着重在这个领域发展的。所以,这个文件的出台,必然也会促使这些有能力的医院加强对临床研究板块的建设,从而逐渐形成统一的高标准的临床研究体制。”
另外值得一提的是,跟之前颁发的不少临床相关法规异曲同工之处就是,《要求》中提到了Ⅰ期临床试验研究室设立专人负责使用临床研究志愿者数据库,以及鼓励药物临床试验研究过程管理电子化等信息化相关要求。
就信息化这个大趋势而言,固然是正确的,但想从管理流程、人员操作上做到完整且高效的信息化,难度是相当大的。
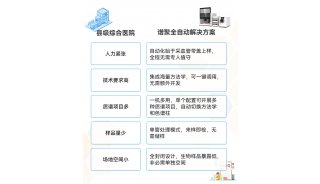
最大的挑战在于,临床研究相对来说是一个规模不大但专业性要求又特别高的领域,当下医院里广泛使用的HIS, LIS, PACE等系统并不适用于临床研究,所以针对性的产品和服务本身就不多,这也是临床研究机构信息化未能普及原因之一。
上海公卫作为一个在全国比较领先的临床研究机构,十分重视信息化的应用,顾俊通过以往经验,谈到信息化系统的选择,他表示:“不光是选择系统本身,更重要的是供应商本身,因为从人工到系统管理会需要3-6个月的磨合整改期,这就十分考验供应商是否灵活、售后服务响应快不快、产品持续升级优化能力强不强、能不能跟着政策和医院实际SOP走等很多背后的软实力。”
目前,上海公卫正在与太美医疗科技合作,重新部署管理系统。太美医疗负责人表示:“这个过程就是在不断发现问题改正问题,有时候需要系统根据SOP进行定制,也有时候要求用户根据系统设计改变一些操作习惯,好在双方的反应都响应迅速,我们对各种问题都能给出让上海公卫满意的解决方法,项目处于顺利推进过程中。“顾俊表示:“我们期待系统上线后,能够切实提高效率,同时对于文件中提到的一些比如药物流转、受试者管理、精准试验记录、统计报表等要求能够标准化执行。”
身处临床研究领域十几年,顾俊主任切身感受十分深刻的一点就是,从整个社会层面提高临床研究认可度对于加强临床研究机构建设至关重要。
据记者了解,在国外,术业有专攻,做临床研究称得上是荣誉,很多人愿意一心一意投身于这个深度领域。但在国内,一名优秀的医生的知名度和被认可度远远高于一位行业知名临床研究者,知名度不提,最显而易见的就是医院的职称和晋升机制,很少有针对临床研究的,想获得晋升就要双管齐下,但是,医生和研究者的工作压力和难度都是很大的,可想而知两者兼顾必然难以达到各领域的高峰。
值得庆幸的是,国家层面对这一点是有所认识的,在《要求》中重点提及了很多人才规划和激励相关的要求,如果推行下去的话,必然会造就出更多专业优秀的临床研究人才,提高临床研究工作的成果,达到促进新药研发的目的。
当下,符合《要求》进行申报并通过审核的临床研究机构并不多。顾俊表示:“我们希望在未来,随着国家对临床研究工作重视度的提高和各项政策的深化落实,涌现出越来越多的专业研究机构,提高我国临床研究整体水平,促进新药研发和上市。 ”