Nature三篇文章揭示剪接体组分突变促进癌症发生
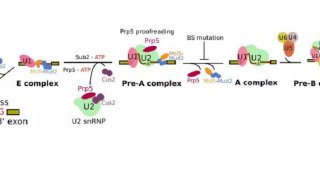
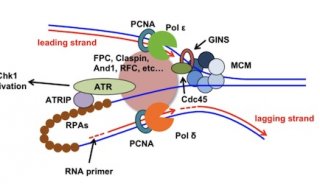
RNA剪接是pre-mRNA去除内含子保留外显子,生成成熟mRNA的过程,对基因的表达具有重要作用。转录本水平的RNA异常剪接在多种癌症类型中被检测到,目前发现与隶属于U2 snRNP的剪接因子SF3B1突变有关。据报道,在髓系白血病、淋巴系白血病和实体瘤中,SF3B1在特定残基位点处反复发生错义突变,在葡萄膜黑色素瘤(uveal melanoma,UVM)中高达14-29%,在环状铁粒幼红细胞骨髓增生异常综合征中高达65-83%。剪接过程主要由U1-U6完成,其中U2主要功能是识别3’剪接位点【1】,突变的SF3B1则导致异常3’剪接位点的使用【2】;U1主要功能是识别5’剪接位点。SF3B1是癌症中最常被检测到突变的RNA剪接因子,但SF3B1突变如何促进癌变的机制目前尚不清楚。是否存在其他剪接组分突变驱动肿瘤发生也有待于进一步研究。
2019年10月10日,Nature杂志3篇背靠背文章对癌症中剪接因子突变进行了报道。这三篇文章的标题分别是(1)Spliceosomal disruption of the non-canonical BAF complex in cancer(2)The U1 spliceosomal RNA is recurrently mutated in multiple cancers(3)Highly recurrent non-coding U1-snRNA mutations drive cryptic splicing in Shh medulloblastom,揭示了U2组分SF3B1突变促进癌变的机制,以及髓母细胞瘤、胰腺癌、CLL、HCC、B细胞非霍奇金淋巴瘤等多种癌症中检测到非编码U1-snRNA发生突变。
第一篇来自美国斯隆凯特林纪念癌症中心的Omar Abdel-Wahab和美国华盛顿大学的Robert K. Bradley 合作研究,利用泛癌剪接分析和CRISPR筛选,鉴定出不同的SF3B1突变都对BRD9产生抑制,BRD9是非典型BAF染色体重塑复合物的核心组分。突变的SF3B1识别BRD9基因内一个异常的内含子支点,诱导了来源于内源性逆转录病毒元件的毒性外显子的形成,导致BRD9 mRNA的降解。BRD9的缺失导致CTCF相关基因位点上非典型BAF复合物的结合丢失,促进黑色素癌变。此外,BRD9被证明在UVM中是一种有效的肿瘤抑制因子,在SF3B1突变细胞中纠正BRD9的错误剪切能够抑制肿瘤生长。

研究人员综合分析SF3B1突变细胞系和249例慢性淋巴白血病、骨髓增生异常综合征和UVM患者样本的错误剪接事件,然后利用CRISPR阳性富集筛选系统进行功能分析。结果显示,BRD9的缺失促进细胞的转化。而且,所有携带SF3B1突变的癌症患者其BRD9都有明显的错误剪接;BRD9敲除能够促进人类UVM、皮肤黑色素瘤、胰腺癌细胞的生长。SF3B1突变导致BRD9内含子序列的外显子化,即毒性外显子的形成,破坏了开放阅读框,引发无义突变介导的RNA降解(nonsense-mediated RNA decay,NMD),降低BRD9 mRNA的半衰期和稳态下全长BRD9蛋白水平,而且没有产生截短的BRD9蛋白。
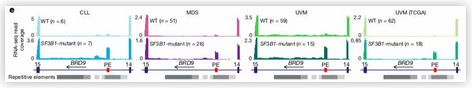
SF3B1突变导致BRD9毒性外显子形成
SF3B1突变如何导致BRD9毒性外显子的形成?据报道,突变的SF3B1促进隐形3’剪接位点的使用,改变野生型SF3B1的分支识别功能。研究发现,SF3B1突变细胞中,BRD9毒性外显子的形成和不常见的闭合分支位点的使用有关;突变闭合分支位点则BRD9毒性外显子的形成消失。同时,研究人员鉴定出毒性外显子形成所必需的外显子剪接增强子(exonic splicing enhancer)。一旦破坏3’剪接位点和/或外显子剪接增强子就能够在SF3B1突变的UVM细胞中增加BRD9蛋白的表达水平,但在SF3B1野生型的细胞中则对BRD9的剪接和表达没有影响。
BRD9和GLTSCR1/GLTSCR1L组成非典型BAF复合物(ncBAF)的一部分,其生化特点和典型BAF、polybromo相关的BAF不同【3】,而且ncBAF和典型BAF在基因组上的靶向位点也不同。虽然ncBAF不像典型BAF、polybromo相关的BAF在癌症中经常发生突变,但SF3B1突变常常破坏ncBAF。无论是SF3B1突变体表达导致的BRD9蛋白水平减少或者化学药物导致BRD9降解,都导致BRD9和BRG1、GLTSCR1的相互作用消失,但BRG1和BAF155的相互作用(在三种BAF中都存在)保持完整,说明SF3B1突变体特异性破坏ncBAF。ChIP-seq实验显示,BRD9和GLTSCR1共定位,与基因的启动子、基因主体和增强子结合;CTCF motifs和GLTSCR1有明显的共定位,和BRG1共定位不明显。而且,SF3B1突变导致的BRD9缺失引发CTCF相关位点上ncBAF的特异性丢失。
最后,研究人员探究了BRD9在肿瘤发生过程中的作用。敲除Brd9或Brg1导致小鼠体内黑色素瘤生长、黑素细胞色素沉积增加,黑素细胞谱系特异性基因的表达增加;异位表达全长的BRD9能够抑制UVM细胞系和肿瘤移植物的生长。Brd9的缺失可能通过肿瘤抑制子HTRA的表达失调,促进细胞的转化、肿瘤的维持和转移进展。此外,利用CRISPR和ASO技术修正SF3B1突变的细胞中BRD9的毒性外显子形成,能够有效抑制体外肿瘤细胞的生长和小鼠体内肿瘤的生长,并诱发肿瘤细胞坏死。

修正SF3B1突变细胞中BRD9的剪接显著降低肿瘤生长速度
总的来说,研究证明了携带SF3B1突变的多种类型的肿瘤中,非典型BAF都被破坏,驱动了肿瘤的进展;同时揭示了BRD9的肿瘤抑制子的功能及其可能的作用机制,并为治疗这类型的恶性肿瘤提供了机制为基础的治疗方案。
第二篇文章来自于加拿大多伦多大学的Lincoln Stein课题组。他们在多种癌症样本中检测到在U1 snRNA的高频热点突变第3个碱基上发生A>C的体细胞突变,而U1的主要功能是通过碱基配对识别5’剪接位点,这种突变改变了U1和5’剪接位点之间的偏好性,从A-U配对改变到C-G配对,导致了新型的剪接连接,改变了包括癌症驱动基因在内的很多基因的剪接模式。临床上,A>C突变和酒精滥用所致肝细胞癌(HCC)和慢性淋巴白血病(CLL)中非突变性侵袭性IGHV亚型相关,同时U1突变对CLL患者的预后不利。

第三篇文章来自加拿大儿童医院的Michael Taylor课题组,报道了在Shh髓母细胞瘤(Sonic hedgehog medulloblastoma,Shh-MB)中U1剪接体snRNA发生高频热点突变(第3个碱基,A>G),而这种突变在其他髓母细胞瘤亚型中没有出现,在36种其他癌症类型的2442个样本中检出率<0.1%。在婴儿Shh-MB中没有检出该突变,但成人期(Shhδ)突变发生率为97%,青少年(Shhα)发生率为25%。U1-snRNA突变导致肿瘤细胞中RNA剪接异常,并导致肿瘤抑制基因如PTCH1失活,激活癌基因如GLI2、CCND2,驱动肿瘤进展。

综上,3篇背靠背的独立研究揭示了U1剪接体蛋白编码基因SF3B1突变导致3'剪接位点的识别出现异常,U2剪接体非编码组分snRNA突变导致5'剪接位点的识别出现异常,进而肿瘤细胞中mRNA出现异常剪接,导致肿瘤抑制因子失活或激活癌基因,促进癌症发生。这些研究提示我们剪接过程或将是癌症治疗中的潜在靶点。
原文链接:
https://doi.org/10.1038/s41586-019-1646-9
https://doi.org/10.1038/s41586-019-1651-z
https://doi.org/10.1038/s41586-019-1650-0
参考文献
1. Cretu, C.et al. Molecular architecture of SF3 band structural consequences of its cancer-related mutations. Mol. Cell 64, 307–319 (2016).
2. Alsafadi, S. et al. Cancer-associated SF3B1 mutations affect alternative splicing by promoting alternative branchpoint usage. Nat. Commun. 7, 10615 (2016).
3. Gatchalian, J. et al. A non-canonical BRD9-containing BAF chromatin remodeling complex regulates naive pluripotency in mouse embryonic stem cells. Nat. Commun. 9, 5139 (2018).