深部真菌感染实验室检验方法的比较
张珩1 柳洋2
(1. 天津市大港医院检验科 2. 德州市中心血站)
关键词:1-3-β-D-葡聚糖,真菌感染,实验室,检验方法
key words: 1-3-β-D- Glucan, Fungus infection, Laboratory,Testing method
一、深部真菌感染的现状及其定义及引起深部真菌感染的因素
真菌与人类有着极为密切的关系,据统计自然界中真菌至少包括50,000种,但是与人类疾病密切相关的真菌种类仅几十种[1]。近年来,真菌感染尤其是深部真菌感染率呈逐年上升趋势[2],深部真菌感染就是指由致病性真菌所引起的人体深部感染,如侵及到皮肤深层如内脏,如肺、粘膜、肌肉、脑、消化道等器官,危害性较大,已越来越严重地威胁着危重患者的健康与生命,成为住院患者感染及死亡的主要原因之一[3]。.据报道,在美国医院内菌血症/败血症病例中,真菌感染在血流感染常见致病菌中居第三或第四位,真菌感染可明显增加病人死亡率和住院率[4]。.由于深部真菌感染的早期诊断困难,治疗药物有限,感染所致病死率仍高达40%[5].因此深部真菌的诊断尤其是快速诊断日益受到临床的重视。深部真菌感染的危害已越来越突出。目前深部真菌感染已成为免疫功能低下患者发病和死亡的主要原因[6]。引起深部真菌常见的致病菌主有念珠菌、隐球菌、曲菌、毛霉菌及放线菌等[7] 我们知道,真菌在人体中,与细菌之间起着重要的微生态平衡作用。近年来,随着抗生素、免疫抑制剂及皮质类固醇激素在临床上广泛应用,器官移植、导管插管等普遍开展,深部真菌感染率越来越高。诱发深部真菌感染的因素主要有以下几个方面:1、慢性消耗性疾病,如恶性肿瘤、糖尿病和尿毒症等,可使机体免疫功能和抵抗力降低。2、长期使用广谱抗生素,敏感的细菌被抑制,消除了正常菌群中与真菌相拮抗的细菌,使真菌得以大量繁殖。3、肾上腺皮质激素破坏淋巴细胞,使抗体形成减少。 4、大剂量X线照射、抗肿瘤药物和免疫抑制剂都能抑制骨髓,使中性粒细胞和巨噬细胞减少,机体的免疫功能和抵抗力降低。5、侵入性检查和治疗(如长时间静脉插管,留置导尿管和大手术)可引起局部损伤,成为真菌侵入的门户,在机体抵抗力低落时在体内繁殖致病。
二、深部真菌感染的危害性及临床预后
据统计,近30年深部真菌感染的发病率增加了3-5倍,真菌感染为艾滋病的重要死亡原因之一[6]。据美国115家医院真菌感染调查显示2004年真菌感染率为1993年的近4.6倍[8];在国内2003年北京协和医院深部真菌感染发生率为20世纪90年代的3.6倍。[9],
深部真菌感染病主要包括深部皮肤真菌病,烧伤真菌病,妇科真菌病、恶性血液病患者的真菌的感染,肺部的真菌感染,外科的真菌感染,老年性真菌病,免疫缺陷患者与真菌感染,消化系统的真菌感染,骨髓移植患者的真菌感染,AIDS与真菌感染等。大量的文献报道表明,严重大面积烧伤患者,由于多次创伤和打击,病程冗长,体质严重耗竭,机体抵抗力下降,往往引起深部真菌感染,从而出现严重后果。据报道,近年烧伤真菌检出率有上升趋势,烧伤病人真菌感染死亡率可达47.4%[10]。在医院的ICU病房中,真菌的感染死亡率最高 [11 ,12] 。据吴铁军等报道[13] 在ICU病房中,肺部真菌感染后死亡率高达39% 上述结果表明真菌已经成为医院感染的主要致病菌之一,是住院病人死亡的主要原因之一,因此要十分重视真菌感染的监测。深部真菌感染发病率高、病情进展快,死亡率高、治疗费用昂贵、临床诊断困难、容易产生耐药等,传统的诊断方法主要有培养、病理切片等方法。但培养耗时长、阳性率低、标本容易受到污染。如痰培养容易受到上呼吸道寄生真菌及空气中的真菌的污染影响培养结果。组织病理很难被病人接受因而在临床工作中开展比较困难。面对持续高烧、抗生素治疗无效的病人,因缺乏快速的客观的实验室诊断依据,贻误治疗。很多医生采用经验性抗真菌治疗,但由于缺少有力的实验室证据、抗真菌药物昂贵等病人家属很难理解,容易激化医患矛盾。目前急需一种能够早期快速诊断深部真菌感染的方法。正是由于诸多的原因及深部真菌感染对患者造成的严重危害程度,对于真菌特别是深部真菌的快速检验愈来愈受到临床医生的重视。
三、实验室检验真菌的常见方法
1、培养与镜检
真菌感染的实验室监测主要有四种方法:直接镜检、微生物培养、血清学实验和DNA探针。直接镜检患者痰、喉或气管分泌物培养阳性率为10%到30%。当血培养显示菌落或放散的分生孢子链时可以得出阳性得结果。只凭借培养检验真菌,至少75%的患者会漏诊[14]。病理切片法加真菌培养可使真菌检验的阳性率增加[15]。
2、分子生物学检测方法
随着科学技术的不断发展,现的诊断技术不断涌现,近年来,用于检则真菌的抗原、抗体及代谢产物的血清学检查和真菌核酸检测(PCR技术)已用于深部真菌感染的实验室检测,并已成为这一领域研究的热点。在国外,用于检测血中和支气管灌洗液中的真菌DNA的PCR的标准已有制定。平板真菌引物针对高度保守多拷贝基因序列,如18s核糖体DNA;使用此引物的分析以及特异寡核苷酸探针的杂交可以检测血中各种的真菌,敏感度达到1-10fg/mL(16,17)。最近出现的实时PCR可以使真菌数量快速扩增,污染减少[18]。,但同时我们还应看到PCR检测真菌的不足,首先,对实验室条件要求较高,应在P3级以上的实验室中才能进行,其次,运行的成本高,使用分子生物学的仪器和试剂均很昂贵。第三,PCR方法学是缺少一致性,缺乏对比。基因芯片技术作为一门崭新的技术,已经在许多检测日得到应用,得到世人的瞩目,但仍然存在着许多如技术成本昂贵、复杂、检测灵敏度较低、重复性差、分析泛围较狭窄等问题。
3.血清学检测方法
反向免疫电泳、免疫荧光、补体结合实验同放免一样依赖于正常的宿主免疫功能,通常在免疫低下的患者检验效率减低。Dupont等人报道乳胶凝集实验的特异性很高,但敏感性不好[19]。 Masahiro等人得出相似得结果,敏感性、特异性和阳性预测值分别为23%、98%和64%。其他检测抗原的实验(如酶联免疫吸附实验)可以提高敏感性,但假阳性率依然很高,约10到20%[20]。
4真菌标志物1-3-β-D-葡聚糖检测
目前,快速检测病原微生物的方法主要有以下五大类:1、 直接从临床标本中检查微生物抗原。(Direct detection of pathogen’s antigens or antibodies from patient’s body fluids.)应用单克隆抗体结合各种形式的放射免疫分析(RIA)、酶免疫分析(EIA)、荧光免疫分析(FIA)、时间分辨荧光免疫分析(TrFIA)、化学发光免疫分析(CIA)、生物发光免疫分析(BIA)等,足以检出临床标本中痕量的(10-18-10-21)微生物抗原,免去细菌或病毒培养过程,直接完成微生物感染的快速诊断。二、 检查某些细菌的专有酶进行快速鉴定。(Detection of specific enzymes of bacteria. ) 已发现某些具有特征性的酶,应用适当的底物可迅速完成细菌鉴。3、 快速检测细菌生化反应的色原或荧光底物及成套鉴定系统。(Chromogenic or fluorescence substrates for rapid identification of bacteria.) 国外以API为代表的细菌生化反应的成套系统中没,已用新型的色原或荧光底物代替传统的糖类和氨基酸。此种底物系由色原(呈色)或荧光与糖类或氨基酸人工合成。此底物无色,经细菌的细胞内或细胞外酶的作用而释放出色原(呈色)或荧光,其优点是特异性强,反应迅速,易于自动化检测,明显提高了细菌生化反应的准确性,实现了细菌生化反应革命性变化。4、 应用不同载体的快速凝集试剂检查与鉴定微生物。(Rapid agglutination tests by coated carriers. ) 所用的载体有聚苯乙烯粒子(Latex),明胶粒子、炭末、含蛋白A 的金葡萄球菌、胶体金、胶体硒。5、快速检测细菌、真菌的毒素或标志物。(Rapid detection of bacterial toxins or markers)自临床标本中直接检出细菌的毒素,常比细菌培养更可靠。大量的研究结果和实践表明,在上述的五大类的方法中,最为特异、敏感、有效的方法为检测细菌、真菌的毒素或标志物的方法。
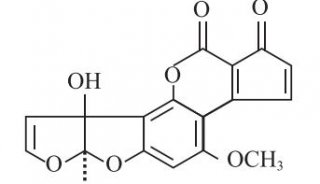
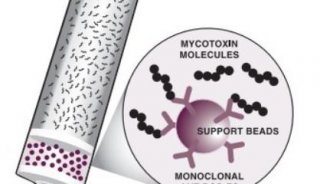
葡聚糖广泛存在于真菌细胞壁中,占其干燥重量的80%-90%。其中1-3-β-D-葡聚糖占真菌壁成分50%以上,尤其在酵母样真菌中其含量可更高,1→3-β-D-葡聚糖是真菌细胞壁的重要组成成分之一,当真菌进入人体血液或深部组织后,经中性粒细胞及吞噬细胞的吞噬、消化处理后,(1→3)-β-D-葡聚糖可从细胞壁释放出来进入血液及其他体液(如尿液、脑脊液、胸腔积液、腹腔积液等)中,我们可以检测到其中的(1→3)-β-D-葡聚糖水平异常升高[21]。在浅部真菌感染中(1→3)-β-D-葡聚糖未被释放出来,故在体液中的量不增高。研究报道将(1→3)-β-D-葡聚糖用于念珠菌血症的早期诊断明显优于传统的培养法和血清学诊断试验[22,23]。有研究显示(1→3)-β-D-葡聚糖在体内的变化与病程呈平行关系[24],连续测定葡聚糖含量有益于预测抗真菌化疗效果[6]。
20世纪90年代初发现,1-3-β-D-葡聚糖可特异性激活自鲎变形细胞溶解产物提取的G因子,从而旁路激活鲎试验,此过程称为G试验。临床上,由于深部真菌感染的严重程度常常与血浆多糖的升高水平一致,故可将G试验应用于深部真菌感染的诊断(包括念珠菌感染和曲菌感染等)。
四、1→3-β-D-葡聚糖定量检测的应用情况
目前,国内的专门用于检测真菌1→3-β-D-葡聚糖仪器是北京金山川科技发展有限生产的MB-80系列,该公司的针对国内外发的情况,结合国内临床使用现状,经过大量实验研究及临床对照,在国内率先开发和研制成功了操作简便,单人次独立使用的体液深部真菌1→3-β-D-葡聚糖动态快速检测试剂盒。其产品已获得国家食品药品监督管理局的批准。
国外,日本和光公司的产品获得FDA批准,同国外的同类产中相比,国内的产品具有性价比高、服务快捷的特点。
据统计到目前为止,全国共有160余家医院、血站等单位使用北京金山川公司的产品,其中包括北京协和医院、301医院、北京友谊医院和上海瑞金医院。普遍反应该产品具有以下几个特点:(1)快速:1小时内即可完成检测。微生物检测属于医院常规检测,传统采用培养法,此方法准确低,时间长,一般需一周左右才能出结果,由于病人大量使用抗生素,常常造成检验结果的不准确。(2)定量:可定量检测待检测物中的真菌1→3-β-D-葡聚糖。定量的结果观察病人的发病程度合理用药十分必要。(3)动态:可动态检测。(4)灵敏:真菌1→3-β-D-葡聚糖的最低检测下限是1pg/ml,完全满足用户的需求。(5)准确:检测病人不受用药的影响,使以往在检测过程中常常出现的假阳性和假阴性的大大降低。(6)操作简便。本仪器具有操作步骤少的特点。只要对操作进行简单培训,操作者在操作过程中严格按照操作说明进行操作,注意无菌操作,即可得到准确可靠的结果。(7)用途广。可用于医院、疾病防治中心及血液中心的血液、干细胞产品等许多样品中的真菌的检测。
北京安贞医院左大鹏主任对北京金山川科技发展有限公司生产的MB-80微生物快速动态检测系统进行了详细的性能评价,评价包括重复性、准确度和比对试验。结果CV值为6.7%具有很好的重复性。与培养法进行了对比,结果见表1
表1 关于真菌1-3-β-D葡聚糖检测结果
------------------------------------------------------------------------
病人 临床诊断 培养结果 检测结果(pg/ml)
------------------------------------------------------------------------
65/M 肺炎 白色念珠菌 79.2
73/M 肺炎 热带念珠菌 45.2
22/F 肺脓肿 毛霉菌 480.9
47/M 肺脓肿 烟曲霉菌 235.1
69/M 肺炎 热带念珠菌 39.5
72/F 尿路感染 光滑念珠菌 50.2
76/M 腹泻 白色念珠菌 22.4
68/F 尿路感染 近平滑念珠菌 30.6
---------------------------------------------------------------------------
据第四军医大学西京医院检验科张建芳,徐修礼,樊新,孙怡群等报道[25]应用MB-80微生物动态快速检测系统及GKT-5M Set动态真菌检测试剂盒定量检测血浆中1-3-β-D葡聚糖的含量,正常对照组血浆1-3-β-D葡聚糖含量为2.83±2.57pg/ml;深部真菌感染组为54.06±36.13 pg/ml。经T-检验分析,对照组与深部真菌感染组1-3-β-D葡聚糖平均值差异非常显著(t=7.741,P<0.001)。血浆1-3--β-D葡聚糖检测可在拟诊早期为临床医生提供机体是否感染真菌的可靠信息,是一种实用的真菌感染早期诊断方法。
五、小 结
综上所述,由于真菌感染致住院及死亡的病人不断增加,对于深部真菌感染的快速检测已越来越重要。到目前为止,国外对于1-3-β-D葡聚糖测定均采用动态定量法,对深部真菌感染的高危病人进行每周2-3次的连续检测,以便早期诊断、早期治疗深部真菌感染。随着国内1-3-β-D葡聚糖测定系统和试剂盒的上市,各大医院和血站已开始引进相关的设备,相信在不远的将来,1-3--β-D葡聚糖检测将在临床检验领域得到快速发展和应用,为临床的早期诊断和治疗深部真菌感染提供帮助。
参 考 文 献
[1] Vanittanakom N, Cooper Jr CR, Fisher MC, Sirisanthana T, etal. Penicillin marneffei infection and recent advances in the epidemiology and molecular biology aspects. Clin microbial rev,2006,1(9):95-110.
[2]P faller M,Wenzel R.Impact of the changing epidemioloy of fungal infections in the 1990s[J].Eur J Clin Microbiol Infect Dis,1992,11(4):287-291.
[3]Mitchell T G, Peryect J R .Cryptococcosis in the era of AIDS 100 years after the discovery of cryptococcus neoformans [J].Clin Microbiol Rev,1995, 8(4): 515-517.
[4]Viudes A, Peman J, Canton E,etal.Candidemia at a tertiary-care hospital: epidemiology, treatment, clinical outcome and risk factors for death. Eur J Clin Microbiol Infect Dis,2002,,21(11):767.
[5]Gumbo T, Isada CM, Hall G, etal.Candida glabrata fungemia: Clinical features of 139 patients. Medicine (Baltimore) 1999,7(4): 220.
[6]Mitchell T G, Peryect J R .Cryptococcosis in the era of AIDS 100 years after the discovery of cryptococcus neoformans [J].Clin Microbiol Rev,1995, 8(4): 515-517.
[7]. Marr KA, Carter RA, Crippa F, etal. Epidemiology and outcome of mould infections in hematopoietic stem cell transplant recipients. Clin Infect Dis 2002,3(4):909–917.
[8]廖军,郝飞.深部真菌感染血清真菌成分检测方法研究进展[J].国外医学临床生物化学与检验学分册,2002,23(2):85-86.
[9]Yoshida M,Roth RJ,Grunfeld C,etal.Soluble 1-3-β-D glucan purified from Candida albicans:biological effect and distribution in blood and organs in rabbits[J].J Lab Clin Med,1996,12(1):103-114.
[10]Zhang yaping. Burn wound pathogens and their drugs sensitinity:afive year survy.Proccedings of the first Sino-American conference on burn injuries.Chongqing,China, [J] Clin Microbiol Rev 1985,4(6):57-59.
[11 ] 文细毛,任南,徐秀华,等. 全国医院感染监控网医院感染病原菌分布及耐药性分析J . 中华医院感染学杂志,2002,12 (4):241-244.
[12] Esmond MB , Wallace SE , McClish DK, etal . Nosocomial blood stream infections in United States hospitals : a three2year analysisJ .Clin Infect Dis , 1999 , 21 (2) : 2392-2344.
[13] 吴铁军, 田锁臣, 哈桂珍 综合重症监护病房医院内肺部真菌感染临床分析 中华医院感染学杂志2003,13 (8 ):727~729.
[14]Levinson W, Jawetz E. Cutaneous and subcutaneous mycoses. In: Medical microbiology and immunology: examination and board review. 5th ed. Stamford (CT): Appleton & Lange; 1998. 33. Brown MJ, et al. Invasive aspergillosis in the immunocompromised host: utility of computed tomography and bronchoalveolar lavage. Clin Radiol 1998,3 (4):255-257.
[15].Robin K. Avery MD,Fungal infections in the organ transplant recipient Curr Opin Organ Transplant 2001, (4) 6:284–289.
[16].Raad I, Henna H, Huaringa A, etal. Diagnosis of invasive pulmonary aspergillosis using polymerase chain reaction-based detection of Aspergillus in BAL. Chest 2002,12(1):1171–1175.
[17].C40 53 Ferns RB, Fletcher H, Bradley S, etal. The prospective evaluation of a nested polymerase chain reaction assay for the early detection of Aspergillus infection in patients with leukaemia or undergoing allograft treatment. Br J Haematol 2002,11(9):720–725.
[18].Pham AS, Tarrand JJ, May GS, etal. Diagnosis of invasive mold infections by real-time quantitative PCR. Am J Clin Pathol 2003,18(9):38–44.
[19]Dupont B, Improvisi I, Provost F, etal Detention de galactommane dans les aspergilloses inavasives humaines et animales avec un test au latex. Bull Soc Fr Mycol Med 2003,7(9):33-36.
[20]Verweij PE, Denning DW. Diagnostic and therapeutic strategies for invasive aspergillosis. Semin Respir Crit Care Med. 1997,1(8):203–215.
[21] Uchiyama M, Ohno N, Miura NN,et al.Solubilized cell wall beta-glucan, CSBG, is an epitope of Candida immune mice[J]. Biol Pharm Bull, 2000,23(5):672-676.
[22] Obayashi T, Yoshida M, Mori T, etal.Plasma (1→3)B-D-glucan measurement in diagnosis of invasive deep mycosis and fungal febrile episodes [J]. Lancet,1994,3(1):17-20 .
[23] Obayashi T, Yoshida M, Tamura H, etal Determination of plasma 1,3-B-D-glucan: a new diagnostic aid to deep mycosis[J].J Med Vet Mycol,1992,30(4):275-280.
[24] 廖军、郝飞、钟白玉等.大鼠实验性系统性白色念珠菌感染血浆β-D-葡聚糖检测初报.临床皮肤科杂志.2003,29(7):373-375.
[25]张建芳,徐修礼,樊新等 深部真菌感染患者血浆1-3-β-D葡聚糖检测的临床意义 中华医院感染学杂志 2005 ,15(3):354-355.