PRMT1调节的坏死和结肠癌免疫的分子机制
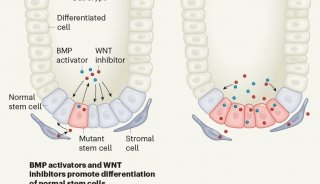
坏死性细胞死亡的特征是细胞肿胀、质膜破裂和细胞器破裂,这与凋亡和其他类型的细胞死亡不同。坏死曾经被认为是一种由物理化学应激引起的不受调节的细胞死亡,直到程序性坏死(称为坏死)被解开。坏死在坏死性癌症细胞死亡和肿瘤免疫逃逸中起着双刃剑的作用。癌症是如何通过免疫逃逸和肿瘤进展导致细胞坏死的,目前尚不清楚。
近日,来自南方医科大学的研究者们在Cell Death Dis.杂志上发表了题为“PRMT1 reverts the immune escape of necroptotic colon cancer through RIP3 methylation”的文章,该研究揭示了PRMT1介导的RIP3甲基化在调节坏死和结肠癌免疫中的分子机制,并表明PRMT 1和RIP3ADMA是癌症有价值的预后标志物。
RIP3(受体相互作用蛋白激酶3)是一种含有丝氨酸/苏氨酸激酶的RHIM(RIP同型相互作用基序)结构域,是细胞坏死途径的中心调节因子。通过TNF(肿瘤坏死因子)以及SMAC模拟物和胱天蛋白酶抑制剂的坏死刺激,RIP3与另一种RHIM结构域激酶RIP1(受体相互作用蛋白激酶1)相互作用,形成称为坏死小体的坏死复合物,导致RIP3磷酸化和活化。激活的RIP3因此磷酸化MLKL(混合谱系激酶结构域样蛋白)并导致坏死性细胞死亡。
研究者发现,坏死的中心激活剂RIP3在人的RIP3 R486氨基酸和小鼠的保守氨基酸R479被PRMT1甲基转移酶甲基化。PRMT1对RIP3的甲基化抑制了RIP3与RIP1的相互作用,以抑制RIP1-RIP3坏死小体复合物,从而阻断RIP3磷酸化和坏死激活。
此外,由于肿瘤浸润的髓源性免疫抑制细胞(MDSC)增加,甲基化缺陷RIP3突变体促进了坏死死亡、免疫逃逸和癌症进展,而PRMT1恢复了RIP3坏死性癌症的免疫逃逸。重要的是,研究者产生了一种RIP3 R486二甲基化特异性抗体(RIP3ADMA。临床患者样本分析显示,PRMT1和RIP3ADMA在癌症组织中的蛋白水平呈正相关,两者均预测患者生存期更长。
综上所述,该研究揭示了由PRMT1调节的坏死和结肠癌免疫的分子机制。PRMT1通过甲基化RIP3蛋白来抑制RIP3磷酸化和坏死活化,从而防止坏死依赖性免疫逃逸,并唤起有益的免疫微环境。而且, PRMT1和RIP3甲基化的蛋白水平可作为癌症预后的分子标记。