SWATH技术常见问题与解答
SWATH(Sequential Window Acquisition of all THeoretical Mass Spectra)采集模式是苏黎世联邦理工学院及AB SCIEX(全球领先的生命科学分析技术公司)的科学家联合推出的一项基于质谱应用的新技术。利用此项技术,科学家有史以来首次可以获得单独蛋白质组学样品分析中每个肽段的数据。
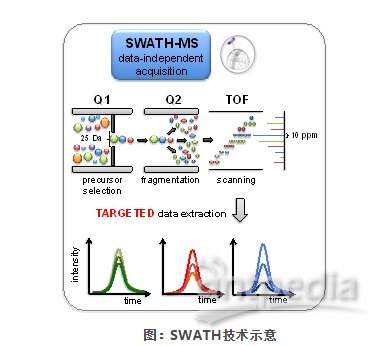
Q: SWATH技术的原理是什么?
A: SWATH是MS/MSALL技术的扩展,其采集模式是一种新型的MS/MS扫描技术,将扫描范围划分为以25Dalton为间隔的一系列区间,通过超高速扫描来获得扫描范围内全部离子的所有碎片信息。
Q: SWATH技术有哪些特点?
A:灵敏度高——SWATH技术继承了MRM的数据采集模式,结合高分辨率的Triple-TOF 5600 plus质谱系统,具有与MRM相当的灵敏度;
可重现性高——重复样品间的定量相关性可达到0.99以上;
定量准确度高——定量准确度几乎与MRM技术相当;
线性动态范围广——定量范围可跨越4个数量级;
Q: SWATH技术可以应用于哪些方面?
A: SWATH技术可以用于蛋白质组定量、蛋白复合体的鉴定和宿主蛋白(HCPs)分析。
蛋白质组定量——对细胞、组织或器官中含有的不同时期、不同条件下蛋白表达水平的研究,生物标志物的寻找都需要对蛋白质进行鉴定和定量。SWATH定量方法基于提取Transition峰面积计算出肽段含量,通过肽段含量推理出蛋白质含量的方法。SWATH定量应用到proteome-wide水平就产生了SWATH定量蛋白组,以此方法为基础可以迅速锁定几个样品间的差异蛋白质。
蛋白复合体的鉴定——在所有细胞功能中,蛋白质间的相互作用是最基本的活动。采用TAP技术将目标靶蛋白的相互作用蛋白特异性富集,然后结合具有高灵敏度、高准确度、高通量等特点的SWATH定量,能够高特异性的准确富集到靶蛋白的特异性相互作用蛋白,实现复合蛋白质的准确鉴定。
宿主蛋白(HCPs)分析——质谱能够在快速有效分析HCPs的同时确保更好的准确度,TripleTOF系统搭配SWATH采集模式分析HCPs,可以全面、准确定量分析的同时获得MSMS信息,一次进样即可完成任意数量HCPs的定量分析工作,并在30分钟的LC梯度内,完成ppm级HCPs的含量测定。
Q:iTRAQ、SILAC和SWATH相比呢?
A:iTRAQ定量蛋白质组方法,该方法不依赖样本,可以做任意样本的总蛋白质的差异定量,而且定量准确。SILAC是仅仅适合细胞层次的蛋白质组定量,组织的定量需要摸索或者前人已经摸索的模式,中途测试新组织难度较大,细胞层次的SILAC培养费用较高。SWATH是目标蛋白质组相关的定量模式, SWATH可以完成数千种蛋白的定量,准确度极高,通量远高于MRM,对于亚细胞结构、细菌、真菌、细胞分泌物等样本,SWATH效果非常好。SWATH本身对物种没有偏向性,也是目标蛋白定量的一种,定量结果准确,可以和MRM媲美,发文章更具有说服力。
Q:采用SWATH技术对样品有什么要求?
A:采用SWATH技术,要求样本物种具有基因组序列、ESTs序列或蛋白质参考序列,适合用于检测细菌等复杂度较低的样本,一般样本蛋白含量至少10ug。
Q:关于“样品重复”,技术重复和上机重复有什么区别?发表的文章一般要求几次重复呢?
A: 一般的文章会要求做2~3次实验重复,仅作1次实验是有风险的,因为如果是实验过程出现问题,缺乏结果的评估,往往说服力不够,对文章发表可能构成影响。
技术重复主要目的是为了验证试验流程的稳定性,当三次上级重复的结果一致或者相似时,我们可以判定对样本的处理过程是稳定的。上机重复的主要目的是验证仪器的稳定性,当三次上机结果接近或者一致,我们即可判定质谱仪性能是稳定的。当前的上机重复仍然在一些JPR和MCP文章中可见,即沿用了早期的习惯。而应用型的文章中,上机重复或技术重复一般没有硬性规定,可以不做,如果做了当然最好,Editor就不会再此处找你的问题。
Q:进行SWATHTM数据处理时,建立离子数据库的最佳方法是什么?
A:现在用于SWATH靶向数据处理的工作流程非常简单,只需要多肽母离子m/z,主要碎片的m/z和相对丰度,以及保留时间。目前建立离子数据库主要使用两种策略:DDA采集数据蛋白鉴定或来源于外部数据库。在第一种方法中,通过信息依赖采集方法(DDA)对样品进行数据采集,蛋白通过ProteinPilotTM软件或其它的搜素引擎进行鉴定,鉴定到的多肽即为用于SWATH数据处理的离子数据库。选择1D LCMS 或者2D LCMS技术路线取决于我们研究对象数据库的复杂度。借助生物信息学方法,还可以对来自于外部数据库的MSMS数据进行靶向蛋白分析,同时创建离子数据库,此时需要进行保留时间校正。
Q:通过SWATHTM方法采集数据时,进行保留时间校正的最佳策略是什么?
A:通过SWATHTM软件进行数据处理时,需要确定一个合理的窄的保留时间窗口,以避免选择错误的色谱峰。现在有两种策略用于校正实际观察到的保留时间和数据库中的保留时间的差异。通过在样品中增加多肽标准品,用于数据库构建和SWATH数据采集,或者使用样品中存在的某些已知的中等/高丰度的多肽作为参考物对保留时间进行校正。
-
企业风采

-
综述
-
产品技术











