革命性的超分辨率显微新技术研究进展
【前言】荧光纳米检测(Fluorescence nanoscopy)技术已经被扩展用于结构生物学。接下来介绍超分辨率显微新技术的研究进展。
多年前,超分辨率成像就已经成为结构生物学中的一种主要技术,增进科学家们对大分子复合物组织的理解。
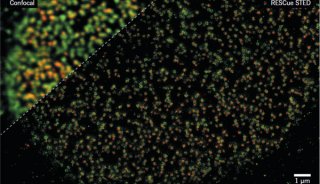
2013年,科学家们借助于低温电子显微镜(cryo-EM)的粒度平均方法(particle-averaging methods),利用单分子定位显微镜(SMLM)的荧光标记蛋白定位,分析细胞核孔复合物(NPC)的结构(Science 341,655-658,2013)。这项研究的基础在于已知的孔隙对称性。尽管在这种情况下并不严格需要,但如果没有之前的基于荧光结构的先验知识,研究也不能顺利开展。时至今日这一研究领域的技术进步已经指出了荧光在结构生物学研究中的越来越多的应用。
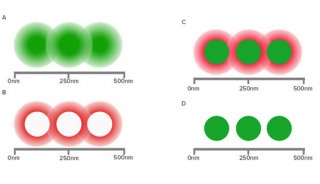
首先,超分辨率方法在分辨率方面正在提高,已经达到了分子级别。在马普生物物理化学研究所诺奖得主Stefan Hell研究小组提出的MinFlux新方法中,首次允许利用光学手段区分彼此间相隔几纳米的分子,也就是说利用MINFLUX可以实现1纳米的分辨率,这是单个分子的直径---在荧光显微镜中可能实现的最终分辨率限制(Science 355,606-612,2017,具体见后)。还有Vahid Sandogdhar研究组报道了低温下利用SMLM实现的蛋白质Å 埃米(Angstrom)分辨率(Nat.Methods 14,141-144,2017)。
其次,基于CRISPR的基因编辑技术能让荧光标记所有内源蛋白拷贝成为可能。再加上更明亮的探针和更小的亲和试剂,这将有助于实现基于荧光的结构作图所需的更完整标记。
同时这也需要改进荧光数据重建结构的分析方法。不需要结构模板并且专门用于荧光数据的特殊方法可能更有效。
科学家们预测,超分辨率荧光显微镜将继续帮助研究人员深入了解生物结构,未来也许可以发展到分子级别。
MINFLUX新荧光显微技术
物理学家Ernst Abbe在1873年提出光学显微镜的分辨率限制在光的波长的一半,大约是200纳米。100多年后,这种阿贝限制(Abbe limit)仍然是有效的。然而马普生物物理化学研究所诺奖得主Stefan Hell第一次证实这种限制能够被STED显微镜克服:他1994年想出这种方法,在5年后,实验性地构建出这种STED显微镜。
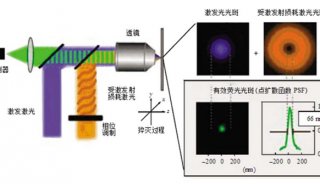
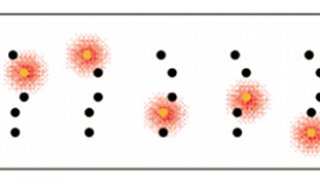
与PALM/STORM一样,MINFLUX随机地开启和关闭单个分子。然而,与此同时,它们的精确位置可通过类似于STED中的圆环形激光束加以确定。不同于STED的是,这种圆环形激光束在MINFLUX中激发荧光产生。如果这个分子位于圆环表面上的话,它将发出荧光;如果它正好位于昏暗的圆环中心的话,它不会发光荧光,但是人们能够发现它的精确位置。
除了实现分子分辨率外,将STED和PALM/STORM结合在一起也提供另一种主要优势:Hell声称,“相比而言,MINFLUX更加快速。鉴于它利用一种圆环形激光束工作,相比于PALM/STORM而言,在获得每个分子最终的分辨率上,它需要更低的光信号或者说更少的荧光光子。”人们已经能够利用STED实时地记录活细胞内部的影像。但是如今,在一种时间分辨率提高100倍的情形下追踪细胞中的分子运动是可能的。他首次成功地利用MINFLUX以一种前所未有的时空分辨率拍摄出活的大肠杆菌中分子运动的影像。研究人员深信在未来,能够研究活细胞中极其快速发生的变化,比如细胞纳米机器的运动,或者蛋白折叠。
参考文献:
Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging
Cryogenic optical localization provides 3D protein structure data with Angstrom resolution
Nanometer resolution imaging and tracking of fluorescent molecules with minimal photon fluxes
-
焦点事件

-
科技前沿
-
产品技术