萜类合成基因与其形成的确切酶学机制获揭示
近日,中国科学院南海海洋研究所研究员闫岩团队联合济南大学博士王文贵、美国加州大学洛杉矶分校教授唐奕团队,完成了对真菌来源的quadrane新骨架倍半萜terrecyclic acid的生物合成研究。相关成果发表于《化学科学》(Chemical Science),并被评为每周亮点论文和2024热点论文。
倍半萜是萜类化合物中占比最多的一种,分子中含15个碳原子,由三个异戊二烯单元组成链状、环状等多种骨架结构,分布于植物、昆虫、微生物等生物中,具有广泛的生物活性,是医药、食品和化妆品研发的重要源泉。Terrecyclic acid是一类由环戊烷骈双环辛烷组合而成的quadrane倍半萜骨架,经过氧化后修饰而成的一类具有抗菌、抗肿瘤活性天然产物。
由于quadrane骨架的特殊结构与良好的生物学活性,其制备方法的研究受到广泛关注。然而,由于该类化合物特殊的结构和成环方式,使得其化学合成步骤多,产率较低,在一定程度阻碍了先导药物的开发。通过合成生物学方法大量制备quadrane类天然产物,是解决这一问题的有效策略。同位素示踪实验表明,quadrane骨架的生物合成可能经历了两种完全不同的途径,即Hirota途径和Coates途径。尽管计算化学研究表明后者的可能性更高,但quadrane骨架的生物合成基因与其形成的确切酶学机制仍有待证实。
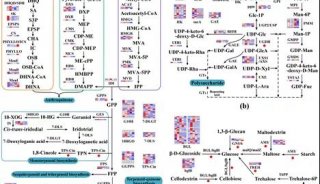
研究团队通过对真菌基因组的挖掘,发现了该类化合物的生物合成基因簇ter,包括一个TC即倍半萜环化酶(β-terrecyclene合酶,TerA)、一个P450氧化基因、一个短链脱氢基因(terC)和一个主要协同转运因子超家族基因。通过异源表达、体内喂养、体外酶反应等研究,验证了基因簇中各基因的功能,证实了其生物合成途径:即在环化酶TerA的作用下催化法尼基焦磷酸产生化合物25,进而产物25被P450酶TerB氧化和羧基化产生化合物32,最后32被脱氢酶TerC催化形成终产物2。
在发现新型TerA可以催化法尼基焦磷酸转化为β-terrecyclene(25)的基础上,通过对TerA的系列定点突变研究,结合动力学同位素效应分析,确证了环化过程为Coates途径,而非最早提出的Hirota途径。该研究发现了抗菌、抗肿瘤quadrane骨架倍半萜terrecyclic acid的生物合成基因簇,以此为基础,解析了其通过β-terrecyclene环化酶TerA形成quadrane骨架,继而氧化、脱氢的后修饰的生物合成过程。
“Quadrane骨架的形成机制也通过对蛋白TerA的点突变和动力学同位素效应得以证实,从而解决了几十年来关于该类天然产物生物合成研究的谜团。”论文通讯作者闫岩表示,该研究为进一步以萜类环化酶TerA为探针,从真菌数据库中对quadrane类天然产物的发掘奠定了基础。