拟南芥突变体纯合植株的获得
实验概要
本实验利用农杆菌转化侵染野生型拟南芥获得变体纯合植株。
实验材料
拟南芥(Arabidopsis thaliana, Col-0),培养条件,长日照为16h光照/8h黑暗,22oC;短日照为8h光照/16h黑暗,22oC。
实验步骤
1. 拟南芥基因组的小量提取
1) 取0.2 g拟南芥叶片,于液氮中研磨成粉;
2) 转入1.5 mL离心管中,加入800 uL 2XCTAB提取缓冲液,充分混匀,65oC保温30 min,其间不时摇动;
3) 加入200uL氯仿,轻轻颠倒离心管混匀,室温下12000 rpm,离心l 0 min;
4) 取上清,转入新的1.5 mL离心管中,加入200 uL氯仿,轻轻颠倒离心管混匀,室温下12000 rpm,离心l 0 min;
5) 将上相转入另一新1.5 mL离心管中,加2倍体积无水乙醇,1/10体积3 mo1/L NaAC C pH 5.2混匀,-20oC沉淀20 min;
6) 12000 rpm离心,弃去上清,干燥沉淀;
7) 30 uL TE回溶。
2. 载体构建
1) PCR扩增
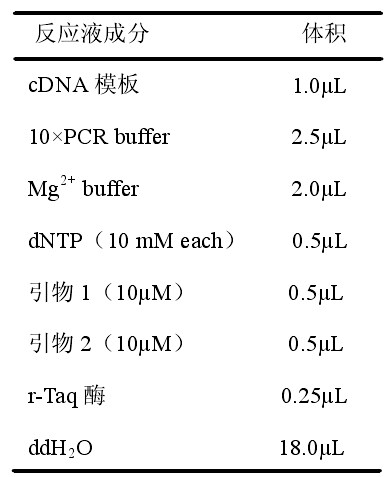
PCR扩增体系为25uL,具体成分如下。
反应步骤为:预变性94oC 5min
循环条件:94oC 30s,50-60oC 30s,72oC 1-2min;循环30次,
后延伸:72oC l0min。
反应结束后,进行琼脂糖凝胶电泳,以检测是否有目的条带,进行下一步试验。
2) 连接反应
连接载体为pGEM-T Easy和pMD 18-T载体,插入片段与载体的摩尔数比为2-10:1两种载体的连接反应体系分别见表A和B。

混匀,16 oC连接3h以上,然后转化大肠杆菌。
3) 酶切
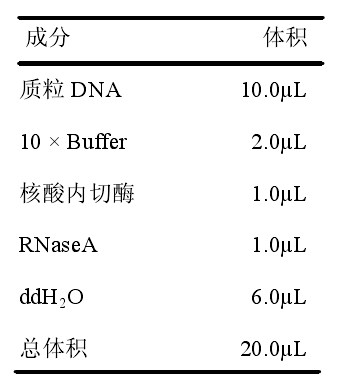
酶切反应体系如下表所示。加样后于37oC放置2-4h,电泳观察酶切片段的位置和大小,以判断酶切情况。
4) 凝胶电泳中DNA片段的回收
用Biometra试剂盒,具体步骤如下:
a. 用干净刀片切下含有目的DNA片段的琼脂胶块,放入1.5 mL离心管中;
b. 按400uL/100mg琼脂糖凝胶比例Binding Buffer,置于50-60 oC水浴l0min,至胶完全融化,期间每隔2min摇动一次;
c. 将融化的胶溶液转移到含有2mL收集管的UNIQ-10柱中,室温放置2min;
d. 室温,12000rpm,离心lmin;
e. 12000rpm,取下UNIQ-10柱,倒掉收集管中的废液,将UNIQ-10柱放入同一个收集管中室温离心lmin;
f. 将UNIQ-10柱放入一个新的1.5 mL的离心管中,在柱子膜中央加入70oC预热的水,室温或37oC放置2min;
g. 12000rpm,室温离心1 min,离心管中的液体即为回收的DNA片段,可立即使用或存于-20oC备用。
5) 超表达载体的构建
利用AtHELPS和AtRDEM的扩增全长引物分别克隆得到基因片段,连接到克隆载体pMD18-T Simple;鉴定其阳性克隆,测序,提取质粒DNA,双酶切后连接到载体pBI121中替换GUS报告基因,再次连接转化筛选后进行农杆菌转化侵染野生型拟南芥。

6) 启动子驱动GUS报告基因表达载体的构建
利用AtHELPS和AtRDEM的启动子引物分别扩增出它们的启动子序列,连接到pMD18-T Simple载体。经测序确定序列无误后,经酶切,连接等一系列步骤,用所研究的基因启动子替换含有GUS报告基因的表达载体中的35S启动子。

3. PCR鉴定突变体纯合植株
将拟南芥种子用70%乙醇消毒5min和2.6%次氯酸钠消毒l0min后,用0.02%的吐温水清洗4-5遍,将种子平铺于GM培养基上。4oC培养3d,移到培养室中长口照培养5d后把生长正常的幼苗移置营养土中。然后取4w后的叶片提取基因组DNA, PCR进一步签定。其原理如下图所示:

LP, RP分别为基因的左边界和右边界,LBbI为T-DNA上的序列。用二条引物进行PCR扩增,结果如右图所示。用LP和RP扩不出条带,而用RP和LBb 1能扩出条带的为突变体纯合株。