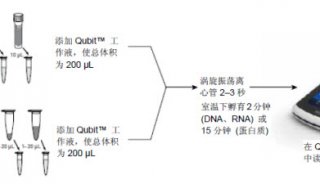
RNA的定量和完整性分析
RNA的完整性可以通过琼脂糖变性电泳分析检测,而含量则通过紫外分光光度计确定。常见的变性电泳有甲醛变性电泳,戊二醛变性电泳等。
甲醛变性电泳检测RNA完整性
一、材料、试剂和仪器
1 材料: 植物总RNA 5-10μg
2 试剂:
1)加样运载缓冲液(Loading buffer),50% 甘油,1mmol/L EDTA (pH 8.0),0.25%溴酚蓝,25%二甲苯氰FF
2)10×TAE Buffer
3)5×甲醛凝胶电泳缓冲液:,0.1mol/L MOPs (pH7.0),40mmol/L乙酸钠,5mmol/L DETA(pH8.0)
4)甲醛, 甲酰胺
3 仪器: 电泳装置,紫外透射观测仪
二、实验程序
1 甲醛变性的琼脂糖(Agarose) 凝胶的配制
在250mL的锥形瓶中准确称量2g Agarose (Sigama),再加20mL 10×TAE Buffer,144mLDEPC处理过的双蒸水,微波炉中化胶,待冷却至50-60℃加EB至终浓度≤0.5μg/mL。在通风橱中加入36 mL甲醛,放置一段时间以减少甲醛蒸汽。
2 RNA的甲醛变性电泳
1) 样品制备,RNA总量10μg,5×甲醛凝胶电泳缓冲液4μl,甲醛 3.5μl,甲酰胺10μl,加入无菌离心管中混合,95℃水浴变性2min(或55℃,15min),取出后放入冰中冷却。
2) 加入2μl无菌的DEPC处理的加样运载液。(使用加样运载液的目的有三: 增大样品密度, 以确保DNA均匀进入样品孔内; 使样品呈现颜色, 便于加样操作; 能明确显现样品在电泳胶上的泳动位置. 以 0.5 X TBE作电泳液时, 溴苯酚在琼脂糖中的泳动速率与长 300 bp 的双链线状DNA相同 , 而二甲苯氰FF 的泳动速率与长 4kb 的双链线状DNA相同)
3)将胶板浸没在1×甲醛凝胶电泳缓冲液中,点样前5V/cm预跑5min。点
样后3-4V/cm电泳。
4)电泳结束后(溴苯酚蓝迁移到约8cm处),紫外灯下观察, 照相。
RNA含量和纯度的测定
一、材料,试剂和仪器
1 材料: 待检测的RNA样品
2 试剂: DEPC-H2O
3 仪器: 紫外分析仪,石英比色杯
二、实验程序
1.开机设定参数 ,具体操作参照仪器说明 。
2.用DEPC-H2O做空白调零。
3.将RNA样品按一定的比例稀释于DEPC-H2O。
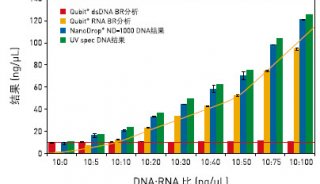
4.混匀样品后在230nm 、260nm、280nm和310nm波长下读数,还可扫描动态吸收图谱。
三 结果与分析
1. 完整的RNA的甲醛电泳可明显地观察到28S和18S两条带(见图3.1),并且28S大约是18S的两倍宽。若两条带不明显, 则说明RNA部分降解,可能的原因是污染了RNase, 或操作剧烈。
2. 定量测定DNA或RNA,应选260nm、230nm、 280nm和310nm波长读数。其中260nm读数用来估算样品中核酸浓度,310nm为背景吸收值。1个OD260值相当于40μg/mLRNA。样品浓度(μg/mL)=[OD260- OD310]×稀释倍数×40,OD260/OD280的比值用于估计核酸的纯度,OD260/OD230估计去盐的程度。对于RNA纯制品,其 OD260/OD280≈2.0,OD260/OD230应大于2。OD260/OD280<2.0可能是蛋白污染所致,可以增加酚抽提;OD260/OD230<2说明去盐不充分,可能是GIT污染所致,可以再次沉淀和70%乙醇洗涤。