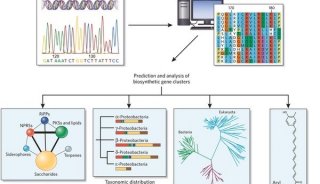
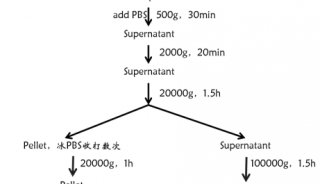
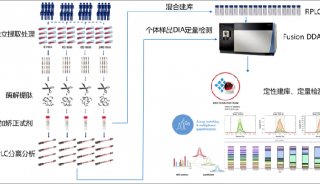
蛋白质组学样品处理方法
蛋白质组学研究已经成为后基因组时代的研究热点,是生命科学研究领域又一个新的突破口。本文从对疏水性强的蛋白质、极性蛋白质、高丰度蛋白的处理、低丰度蛋白的富集和对样品溶液中干扰性物质的去除以及对不同染色后质谱前处理等方面综述了蛋白质样品的一般处理方法。
1. 不溶性蛋白质的处理
天然状态的蛋白质溶解度一般较低,蛋白质的增溶作用影响着最终结果并且决定着整个实验成败。由于蛋白质的异原性和非蛋白类杂质的影响,使所有的蛋白质同时溶解仍具有很大的挑战性。目前增加蛋白质溶解性的原理是加入试剂破坏蛋白质多聚体内部的相互作用力,使蛋白质多聚体裂解为单个的多肽而具有强的溶解性,这些试剂包括离液剂(尿素和硫脲),去污剂(CHAPS和Triton-100),还原剂(DTT,TBP)和蛋白酶抑制剂等。
尿素是一种中性的离液剂,浓度为5-9 mol/L的尿素可以有效破坏蛋白质的二级结构使蛋白质展开并暴露出可电离的结构群体使之溶解性增强。值得注意的是尿素和硫脲在温度较高时可分别水解成氰酸盐和硫氰酸盐,导致蛋白质人为的修饰,所以样品温度不要超过37 ℃,同尿素缓冲液中加入两性电解质载体可以清除氰酸盐。目前提高与膜脂质形成复合物的膜相关蛋白的溶解度是当今蛋白质组学研究中样品处理的最大挑战,去污剂对膜蛋白复合物的提取是极其重要的。去污剂分为离子型(SDS)、非离子型(TritonX-100)和两性离子型(CHAPS和ASB-14),去污剂的浓度范围一般为1%--4%。离子型去污剂对疏水性蛋白质和膜蛋白的增溶作用效果较好,但干扰非变性电泳和等电聚焦,为不影响SDS-PAGE,最好选用两性离子和非离子去污剂。
2. 可溶性蛋白质的前处理
不可溶性蛋白质经过处理溶解度增加成为可溶性蛋白质,但是,样品中还有很多其它干扰物质,如实验中处理用的缓冲液、盐类、脂质、糖类、核酸和去污剂等都会阻碍蛋白质分离,显色,鉴定等步骤,使数据分析复杂化,必需将其除去。
蛋白样品中的盐类组分可使蛋白质发生沉淀和聚集,一般通过超滤,透析,TCA沉淀,凝胶过滤或者有机溶剂和固相萃取等方法经行除盐,另外也可用商品化的试剂盒进行除盐。相比透析法,超滤法的吸附主要发生在过滤器上,可以减少蛋白量的损失。柱子去盐法的优点是具有蛋白复性的功能。现已有商业化微离心过滤装置用来除去污染物。脂质物质广泛存在于生物的机体内,并和许多蛋白质结合形成复合物,造成蛋白质的溶解度降低,甚至影响等电点和分子量。另外,蛋白质样品中存在的多聚糖和核酸与两性电解质反应并堵塞聚丙烯酰胺胶上的小孔,易发生蛋白沉淀或者使聚焦时间延长而使双向电泳胶上出现纹理。相对来说,离子交换层析可有效地去除非离子和两性去污剂。此外,SDS可以用纳米级亲水相层析或丙酮沉淀去除,在-20 ℃时效果比室温要好。对于两性去污剂的去除,凝胶过滤层析和去污剂亲和层析效果相当,略优于透析。同样,SPE (固相萃取) 在稀释的蛋白溶液中去除CHAPS很有效,比标准的透析或凝胶过滤层析有更好的效果。
3. 高丰度蛋白的去除和低丰度蛋白的富集
高丰度蛋白会影响到低丰度蛋白的聚焦,降低了装载容量,从而掩盖了双向图谱中一些重要的蛋白位点,丢失了重要的信息;相反,很多低丰度蛋白质在生物机体内发挥着非常重要的作用,在蛋白样品中含量却很低,所以在电泳前必须进行高丰度蛋白的去处和低丰度蛋白的富集。血浆,血清和脑脊液是很重要的蛋白质组研究对象,这些样品中往往90%的蛋白是高丰度蛋白,如白蛋白,免疫球蛋白等。这些高丰度蛋白影响到分子量相似的低丰度蛋白的检测例。如今,很多公司都开发出去除高丰度蛋白的试剂盒,如BIO.RAD Aurum Serum Protein Mini Kit试剂盒等。丙酮、TCA、异丙醇、硫酸铵、乙醇、氯仿/甲醇,聚乙烯乙二醇(PEG)或亲和层析试剂是常用的蛋白质富集试剂。另外,免疫沉淀反应也可以应用到蛋白质的富集中,其原理是抗体和抗原结合反应,能够选择性地富集一种或一类具有相似抗原的蛋白质。蛋白质富集最简单的方法是超速离心法。亚细胞器的分离是利用该混合物的密度特征通过一系列不同的速度离心,或者用蔗糖/甘露醇梯度分离进行富集嘲,如线粒体,膜蛋白,核蛋白或其它亚结构蛋白质的富集都是通过此种方法实现。另外,层析分离可根据蛋白质的电荷,疏水性,大小或特异性来分离纯化和富集蛋白质。
4. 质谱鉴定前蛋白质样品处理
胶内蛋白点(带)在进行质谱鉴定前需先脱色。银染脱色一般使用30 mmol/L铁氰化钾与100 mmol/L硫代硫酸钠等比例混合溶液;考染脱色一般使用含50 mmol/L碳酸氢铵的50%乙腈水溶液。胶内蛋白质处于变性状态,在质谱鉴定前需还原蛋白质。试验证明,经含10 mmol/L二硫苏糖醇(DTT)的100 mmol/L碳酸氢铵溶液处理后可较好的还原蛋白质。蛋白质还原后还需经过几步处理包括:含有55 mmol/L碘乙酰胺(IAA)的100 mmol/L碳酸氢铵溶液暗处处理30 min, 100 mmol/L的碳酸氢铵溶液,室温处理15 min;100%ACN室温震荡5 min后吸去,冻干;冻干后加入Trypsin溶液,置于4 ℃ 30--60 min,使胶块充分吸胀,移走过量的胰酶溶液;再加入50 mmol/L的碳酸氢铵溶液,使胶块在酶解过程中保持浸润;吸出酶解缓冲液,加入含有0.1% TFA的60%乙腈水溶液,超声15 min,吸出溶液并入前次溶液,重复一次,溶液冻干。
所以,蛋白质组学样品处理可从两方面分析,一是双向凝胶电泳蛋白样品处理;二是质谱蛋白样品处理。双向凝胶电泳主要进行可溶性蛋白的分离圈,所以处理方法的改进可以提高样品的溶解度,去除非蛋白类杂质的干扰,最大程度还原样品的真实状态,增加试验结果的可靠性。质谱技术用于鉴定蛋白样品,对蛋白质的纯度要求较高,样品处理后可达到鉴定的敏感性和可靠性。由于蛋白质数量多、化学结构和性质各异、样品组分复杂,经过近30多年的发展蛋白质组学仍处于初级阶段,样品处理至今没有统一的标准。一些特殊蛋白质,如膜蛋白,极性蛋白,高分子量和低分子量蛋白等还有待进一步的研究。此外,细胞器内蛋白质、磷脂肽、糖化蛋白等与信号通路相关的蛋白质将会成为研究的热点,势必会对蛋白质组学样品处理技术提出新挑战。随着蛋白质组学样品处理技术的突破性发展,将会推动双向凝胶电泳分离技术和质谱鉴定技术在蛋白质组学中发挥更显著的作用。