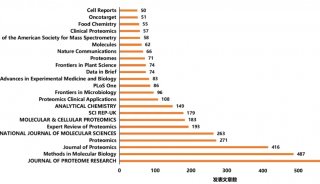
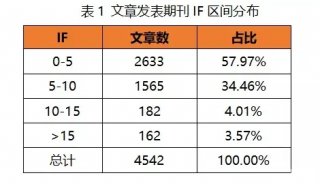
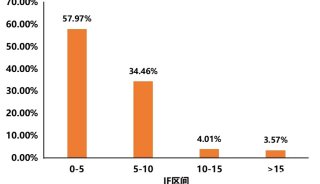
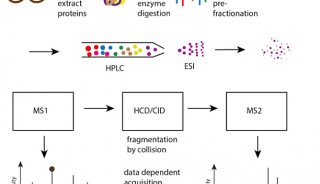
顽拗性植物组织的蛋白质组学研究(苯酚法提取蛋白质)
1. 前言
提取蛋白质是蛋白质组学研究的第一步。植物组织的蛋白质含量较低,并且存在多种非蛋白质成分,如细胞壁及贮藏多糖、脂质和酚类化合物,使蛋白质的提取难度增大 。植物蛋白质的可溶性与它们的细胞内定位关系密切,传统的蛋白质提取方法是用水合缓冲液、去垢剂或直接沉淀法
[1] 。除了普遍使用的 TCA/丙酮沉淀法, Hurkman 和 Tanaka 在 1986
年报道了一种先用苯酚提取然后用甲醇/乙酸铵沉淀的蛋白质提取方法,能有效去除核酸干扰,因为核酸可以与蛋白质相互作用,使双向电泳背景深,分辨率低。
苯酚提取法首先是应用于纯化碳水化合物(去除蛋白质),然后是用于纯化核酸。对于分子生物学家来讲,酚抽提是一种从核酸溶液中去除蛋白质的首选方法。
苯酚是最简单的芳香醇,芳香环上带有一个极性羟基,弱酸性,并且有腐蚀性和毒性。苯酚与水部分混溶:当达到饱和时,水相含有大约 7% 的苯酚,有机相含有大约 28% 的水。苯酚主要是通过氢键和蛋白质相互作用,使蛋白质变性并且溶于有机相中。因此,和一般认为的不同,蛋白质并不是留在水相和有机相的界面上,而是进入了苯酚中。
苯酚提取法主要应用于研究黏韧性植物组织或器官,如木薯 [4] 和油菜的幼苗 [ 5 ] ,马铃薯、苹果和香蕉的叶片[6],橄榄叶 [7] ,以及番茄、鳄梨和香蕉的果实 [ 8] 。
Carpentier
等、Saravanan 和 Rose 比较用
TCA/丙酮沉淀法和苯酸提取法从黏朝性组织中提取蛋白质,发现两种方法都有效,但苯酚提取法能够更有效地除去干扰物质,得到背景浅、垂直拖尾少的高质量凝胶。这两种方法可减少蛋白质在样品准备过程中由于内在蛋白质水解活动而引起的降解。同时,苯酚提取法可以得到更多糖蛋白。
苯酚提取法有高度的清洁能力。它能够作为一种分离剂,降低蛋白质和其他分子间的相互影响。苯酚提取法最主要的不足在于它时间消耗过长(至少 6 h) ,另外苯酚和甲醇都是有毒的。
2. 材料
2.1 苯酚
饱和 Tris-HCl 缓冲液,pH 6. 6/7.9 ( Amresco- Interchim, biotechnology grade) 。
2.2 提取缓冲液
准备一份含有 500 mmol/L Tris-HCl 缓冲液、500 mmol/L EDTA、700 mmol/L 蔗糖 、100 mmol/L KCl 的溶液,并用 HCl 调 pH 至 8.0。这种溶液可以在 4°C 保存一周。
在提取之前加入 2% β-疏基乙醇和 1 mmol/L 苯甲基磺酰氟 ( PMSF,见注释 1)。
2.3 沉淀液
含 0.1 mol/L 乙酸铵的冷甲醇。此溶液可以被保存在 -20°C。
2.4 等电聚焦缓冲液
9 mol/L 尿素、4% CHAPS、0.5% Triton X-100、20 mmol/L 二硫苏糖醇 ( DTT ) 、1.2% 两性电解质(pharmalytes),pH 3~10 ( 见注释 2 ) 。Triton X-100 的初始浓度为 10%。这种溶液需分装后保存在 -20℃,可保存数月。
2.5 测定蛋白质溶液的浓度
用来自 Bio-Rad 的染色剂,根据改良的考马斯亮蓝法,测定蛋白质浓度(见注释 3) 。
4. 注释
( 1 ) 注意:β-巯基乙醇和 PMSF 是有毒化合物。PMSF 可制成溶于异丙醇中的 200 mmol/L 贮备液,分装保存在 -20°C 条件下。
( 2 ) 不要加太多的水溶解 CHAPS 和尿素粉末,如 25 ml 终体积,约 10 ml 水即可。准备此溶液时,避免加热到 30°C 以上,防止蛋白质的氨基甲酰化。溶解时间比较长。
( 3 ) 染色剂稀释要根据 Bio-Rad 说明手册中进行准备。
( 4 ) 得到研磨充分的粉末是非常重要的。研磨得越充分,蛋白质的提取和除去掉污染物的效果就越明显。为了精确地进行样品比较,粉末要研磨均匀。
( 5 ) 这一步骤特别注意保持低温以抑制蛋白酶活性。
( 6 ) Tris 饱和苯酸要根据生产商说明来准备,并贮存在 4°C。在容器中,苯酚密度大于 Tris 溶液。一次性吸出所需体积的苯酚,以避免两相相互混溶。
( 7 ) 这里有一个小技巧,就是在提取缓冲液中加入蔗糖,使两相位置发生改变。
( 8 ) 在 -80°C 贮藏充分干燥的蛋白质沉淀,以延缓沉淀再次溶解的可能。恢复到室温时,置于真空干燥器中以防止蛋白质再水化。
参考文献
1. Michaud, D. and
Asselin, A. (1995) Application to plant proteins of gel
electrophoretic methods. J. Chromatogr. A698, 263-279.
2 .
Damerval, C., Zivy, M., Granier, F., and de Vienne, D. (1988) Two-
dimensionalelectrophoresis in plant biology. Adv. Electrophoresis 2,
263 —340.
3. Hurkman, W. J. and Tanaka, C. K. (1986)
Solubilisation of plant membraneproteins for analysis by
two-dimensional gel electrophoresis. Plant Physiol. 81,802— 806.
4.
Mijnsbrugge, K. V., Meyermans, H., Van Montagu, M., Bauw, G., and
Boerjan,W. (2000) Wood formation in poplar: identification,
characterization, and seasonalvariation of xylem proteins. Planta 210,
589-598.
5. Mihr, C. and Braun, H. P. (2003) Proteomics
in plant biology, in Handbook ofProteomics(Conn, P., ed.), Humana
Press, Totowa, NJ, pp. 409^416.
6. Carpentier, S. B., Witters,
E., Laukens, K., Deckers, P., Swennen, R., and Panis, B.(2005)
Preparation of protein extracts from recalcitrant plant tissues: an
evaluationof different methods for two-dimensional gel electrophoresis
analysis. Proteomics5 , 2497-2507.
7. Wang, W., Scali, M.,
Vignani, R., et al. (2003) Protein extraction for two-dimensional
electrophoresis from olive leaf, a plant tissue containing high levels
of interfering compounds. Electrophoresis 2 4 ,2369-2375.
8 .
Saravanan, R. S. and Rose, J. K. C. (2004) A critical evaluation of
sample extraction techniques for enhanced proteomic analysis of
recalcitrant plant tissues.Proteomics 4, 2522-2532.
9.
Bradford, M. M. (1976) A rapid and sensitive method for the
quantitation ofmicrogram quantities of protein utilizing the principle
of protein-dye binding. Anal.Biochem. 72, 248-254.
10. Lowry,
H., Rosebrough, J., Farr, A. L., and Randall, R. J. (1951) Protein
measurement with the folin phenol reagent. J. Biol. Chem. 193,
265-275.
11. Ramagli, L. S. and Rodriguez, L. V. (1985)
Quantification of microgram amountsof protein in two dimensional
polyacrylamide gel electrophoresis sample buffer.Electrophoresis
6,559-563.