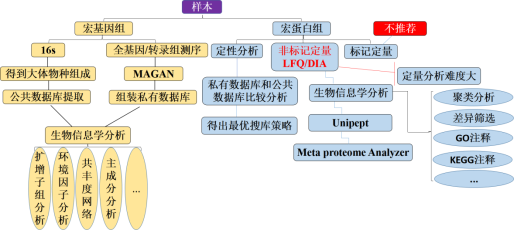
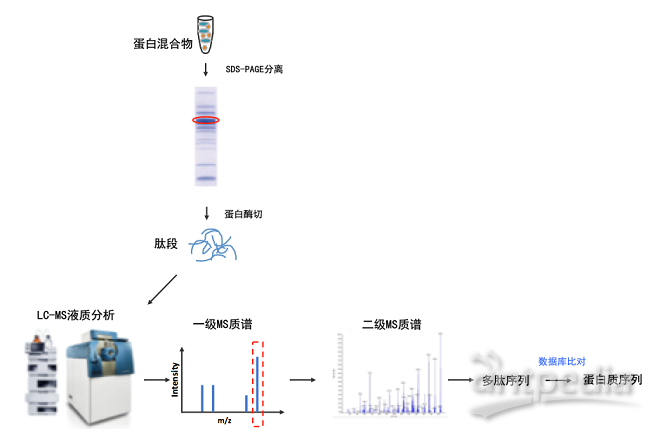
如何提取蛋白质?
对于每个大肠杆菌表达的目的蛋白,确定其产生、定位及估计培养基或细胞中的产量都相当重要。为了简化确定工作,通常对总细胞蛋白及培养液、周质、可溶胞质和不溶胞质部分进行小规模分析。分析的结果有利于诱导条件优化或确定大规模诱导条件,以及采用合适的蛋白抽提方法用来纯化目的蛋白。下面简单的介绍总细胞蛋白的提取与分析。
1、生长和诱导
1)按如下操作准备 pET 重组子(DE3 溶原菌)的起始培养液:从平板或甘油保存菌中接一环细胞加入3ml 含有适当抗生素的培养液中。
2)37℃ 250rpm培养至OD600约为0.5。取3ml 培养液加入100ml 含抗生素的培养基中。
3)在适当温度摇床培养至OD600约为0.5-1.0(如LB培养基2-3 小时,37℃)。生长过程中无菌条件下取出样品测定OD600值。
4)在诱导之前,将100ml 培养液分为2份各50ml。其中一份加入IPTG,另一份不加IPTG 作为不诱导对照。对于带有T7lac 启动子的质粒,加入IPTG 至终浓度1mM (500μl 无菌的100mM IPTG),而对于普通T7 启动子加入200μl IPTG至终浓度为0.4mM。对于lacY突变菌株(Tuner,Rosetta-gami和Origami B)可改变IPTG浓度。在适当温度培养适当的时间。注意,当融合蛋白被运输至周质,延缓诱导(16小时或过夜)可以促进蛋白渗漏入培养基中。
2、诱导培养物的光密度分析
1)在诱导后收集细胞前,充分摇荡使上清液均匀,在诱导和未诱导的培养液中各取出0.5-1ml。
2)尽量准确的确定 OD600值。可以通过用相同的培养基进行稀释(通常为1:5 到1:10稀释)使OD600读数在0.1和0.8之间。
3)在工作表中记录稀释倍数和 OD600读数。
3、总细胞蛋白的提取
1)在细胞富集之前,取1ml 培养液离心1 分钟。去除上清液。倒置使沉淀流干,过多的培养基由纸巾吸干。
2)与 100μl 的磷酸缓冲盐(PBS)混和以重悬沉淀。
3)加入 100μl 的4×SDS上样缓冲液与一个小枪头按如下设置进行超声波处理:电力水平2-3,功率20-30%(Branson Sonifier 450,超声条件可按仪器的不同而改变)。另外,将样品流经27 gaμge needle 几次以降低其粘稠度。
4)迅速在 85℃加热样品3 分钟使蛋白变性,SDS-PAGE分析之前-20℃保存。
4、优化 SDS-PAGE电泳上样体积
为了简化凝胶电泳和 Western分析,可以用两张工作表来记录数据和计算对标准小块胶规格化的上样体积。公式取决于准确的OD600 的读数以及浓度系数的获得。样品浓度系数等于初始培养液体积除以最终体积。
-
仪器推荐
-
仪器推荐

-
仪器推荐
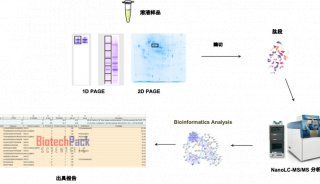
-
仪器推荐

-
仪器推荐

-
焦点事件