双杂交和其他双成分系统实验(三)
第三阶段 阳性相互作用的再次确定
材料
缓冲液和溶液
乙酸铵(7.5 ml/L)
氯仿
乙醇
异丙醇
裂解液
酶解酶 100T 以 2~5 mg/ml 溶解于拯救缓冲液中或β-葡糖醛酸酶 100000 单位/ml(Sigma)按 1:50 稀释于拯救缓冲液中每次使用均需配置新鲜的溶液。
酚(早衡至 pH8.0)
拯救缓冲液
50 mmol/LTris-Cl(pH7.5)
10 mmol/LEDTA
0.3%β-巯基乙醇
每次使用均需配置新鲜的溶液。
SDS(10%,m/V)
STES 裂解液
100 mmol/LNaCl
10 mmol/L Tris-Cl(pH8.0)
1 mmol/LEDTA
0.1%(m/V)SDS
TE(pH8.0)
酶和缓冲液
限制性内切核酸酶 Eco RI,XtoⅠ,Hae Ⅲ
凝胶
琼脂糖凝胶
请参见步骤 5。
培养基
CM 选择培养基
利用表 18-3 估计所需培养基的量,并根据表 18-9 制备所需的选择培养基。
无氨基酸的酵母氮源(YNB) 分含或不含硫酸铵两类,均有销售。表 18-9 中假定 YNB 中含有硫酸铵。如果酵母氮源包装瓶上说明制备培养基需加 1.7 g/L 酵母氮源,那么它就不含有硫酸铵,配制时毎升培养基中应加入 5 g 硫酸铵。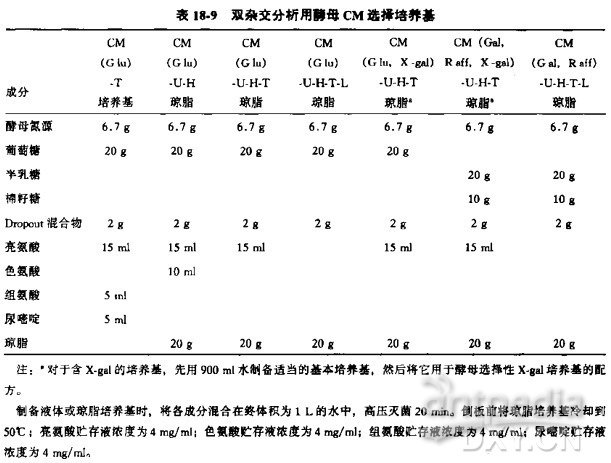
含 50ug/ml 氨苄青霉素的 LB 琼脂平板
细菌基本培养基(色氨酸缺乏)
制备下列高压灭菌贮存液:
1.20%(m/V)硫酸镁
2.4 mg/ml 尿嘧啶
3.4 mg/ml 组氨睃
4.4 mg/ml 亮氨酸
5.20%(m/V) 葡萄糖
制备下列过滤除菌溶液:
6.50 mg/ml 苄青霉素
7.1% 盐酸硫胺素
分别高压灭菌下列两种溶液:
8.15 g 琼脂溶解于 800 ml 蒸馏水中
9.10.5 g 磷酸氢二钾
4.5 g 磷酸二氢钾
1 g 硫酸铵
0.5 g 柠檬酸钠
160 ml 蒸馏水
将溶液 8 和 9 冷却至 50°C,混合。迅速加入 1 ml 的溶液 1.10 ml 的溶液 2,10 ml 的溶液 3,10 ml 的溶液 4,10 ml 的溶液 5,lml 的溶液 6,以及 0.5 ml 的溶液 7。彻底混合终溶液,马上倒制平板。
酵母选择 X-gal 培养基
i. 按照表 18-9 所述,在 900 ml 水中制备基础培养基,高压灭菌后冷却至 55°C
ii. 在另外一个瓶子中,7 g 磷酸氢二钠和 3 g 磷酸二氢钠溶于 100 ml 蒸馏水中, 高压灭菌。
iii. 把两种高压灭菌溶液混合在一起,加入浓度为 100 mg/ml 的 X-gal 溶液(溶于 N,N-二甲基甲酰胺)0.8 ml, 倒制平板。
离心机和转子
Sorvall RT6000 离心机,H1000B MPC 和 H6000A MPC 转子(离心微量滴定板用)
专用设备
玻璃珠(直径 0.45 mm, 无菌;Sigma)
微量滴定板(24 孔或 96 孔 [可选])
重复用移液管
可选,请参见步骤 1。
附加试剂
此方案的步骤 2 需要第 1 章方案 26 中列出的电穿孔试剤。
此方案的步骤 3 和 4 需要第 1 章方案 1 中列出的小量质粒 DNA 制备用试剂。
此方案中步骤 10 需要第 4 章方案 13 中列出的酵母 DNA 测序试剂。
载体、细菌和酵母菌株
适用于电穿孔的大肠杆菌 DH5a 或大肠杆菌 KC8(pyrF leuB600 trpC hisB463;CLONTECH)
请参见第 l 章,方案 26。
非特异性诱饵质粒
请参见步骤 6 说明。
PMW112,pRFHM-1
pBait(来自第一阶段)
在 CM(Glu)-Ura-His-Trp 主极上生长的具适当表型的酵母克隆(第二阶段步骤 21 已鉴定)
酵母菌株 EGY48
方法
阳性质粒的分离提供了两种分离离散文库质粒的方法。分离少量的菌落时,将细胞在 SDS 中裂解;分离大量的菌落时,细胞用酶解酶(zymolyase) 裂解。
(1) 从阳性菌落中制备细胞裂解物
1) 少量菌落的分离
一般来讲,即使阳性菌落的数目数以百计,一些研究人员也宁愿用这种方法去逐步处理最初得到的全套阳性菌落,而在同时处理约 24~36 个或更少的菌落时,这种方法则是最为好用的。在通常的情况下,利用这个方案结束处的替代方案从普通生长的阳性菌落中区别出单一序列,不失为一个较为有效的方法。
a. 从 CM(Glu)-Ura-His-Trp 主板开始(第二阶段步骤 21), 挑取在选择培养基上呈现合适表型的菌落至 5 ml 的色氨酸缺乏的葡萄糖培养基中,30°C 过夜培养。在这种情况下省掉-Ura-His 筛选可以促进非文库质粒的丢失,使分离希望得到的文库质粒变得更为容易。
b. 室温下使用小型离心机以最大转速离心毎个培养液中的 1 ml 培养物 1 min, 在 200ul 的 STES 裂解液中重新悬浮沉淀,加入 100ul 直径 0.45 mm 的无菌玻璃珠,剧烈振荡试管 lmin。
c. 每个试管中加入 200ul 平衡酚,再次剧烈振荡 1 min。
d. 室温下使用小型离心机以最大转速离心乳浊液 2 min, 分别把水相转移至新的小离心管中。
e. 每个水相中加入 200ul 的平衡酚和 100ul 的氯仿,振荡 30s。室溫下使用小型离心机以最大转速离心乳浊液 2 min, 分别把水相转移至新的小离心管中。
f. 每个水相中加入两倍体积(400ul) 的乙醇,翻转混合,-20°C 冷冻试管 20 min,4°C 条件下使用小型离心机以最大转速离心 15 min 来回收核酸。
g. 弃去上清。用冷的 70% 乙醇洗涤沉淀,真空条件下使沉淀大致干燥后,在 5~10ul TE(pH8.0) 中重新悬浮每份沉淀。进行步骤 2。
2) 大量菌落的分离
下面制备多批 DNA 的实验方法是由 Steve Kron(芝加哥大学)建立的,在它是对 Manuel Claro(巴黎基因技术分子实验室)最初建立的实验方案的一种放大。需要带有平板固定器(或托盘、支架)的冷冻离心机和可以重复使用的移液管。
a. 在 24 孔微童滴定板的每个孔中加入 2 ml 2xCM(Glu)-Trp 培养基。用牙签从主板上挑取假定的阳性克隆到微量滴定板的孔中(第 2 阶段步骤 21),30°C 摇动微量滴定板培养过夜。
使用 2X 基础培养基增加了酵母的产通常可以方便地处理 4 个平板,并在一个离心机中同时离心。
b. 使用带有平板支架的离心机,4°C、1500 g(使用 Sorvall H1000B MPC 转子 3000r/min) 离心 5 min。用手甩动平板去掉上清液,平板正面向上放置,摇动或轻轻振荡平板使细胞沉淀重新悬浮于保留的培养液中。每个孔中加入 1 ml 水轻轻播动平板。
加入新的溶液之前,细胞沉淀最容易重新悬浮于残余的液体中。可以使用重复用移液管添加溶液。
c. 如步骤 b 般离心,甩掉上清液,重新悬浮细胞沉淀于残留的上清液中,加入 lml 的拯救缓冲液。
d. 如步骤 b 般离心,甩掉上清液,重新悬浮细胞沉淀于平板上少量的残留上清液中,每个孔中加入 25ul 的裂解液,摇动或振荡平板,在旋转摇床上 37°C 培养平板(需加盖)约 1 h。
裂解液使用前不需要完全溶解。经过 1 h,酵母细胞凝结为白色的沉淀时,即明显可见裂解现象。酵母菌株对裂合酶的敏感性各不相同。如果裂解现象出现得很快,那么就使用较少的裂合酶。如果裂解处理的时间过长, 过多的部分溶解细胞垫将可能污染最后的材料。可以通过在相差显微镜下检査细胞来判断裂解情况。活细抱是带有黑的晕圈的白色,死细胞是均匀的灰色。裂解会把细胞中的顆粒内容物释放到培养基中。一旦细胞大部分都变成灰色并且许多细胞已经破裂,即可假定为许多质粒已经释放了出来。
e. 每个孔中加入 25ul 的 10%SDS。摇动平板完全溶解沉淀。室温下把平板在桌面上放置 lmin。1 min 后,平板上的孔中应为清亮的、稍微黏稠的溶液。
f. 每个孔中加入 l00ul 的 7.5mol/L 乙酸铵。轻轻振荡平板,然后-70°C 或-20°C 放置 15 min 直到裂解物被冷冻为止。
乙酸盐的加入导致了细胞碎屑和 SDS 块状沉淀的形成。冷冻步骤促进了大扬杆菌转化抑制物的去除。







