mRNA研究继新冠疫苗一战成名后再获诺奖 考里科解决的难题是啥?
北京时间昨天17时45分许,2023年诺贝尔生理学或医学奖揭晓。
据瑞典斯德哥尔摩卡罗林斯卡学院消息,本年度诺贝尔生理学或医学奖授予匈牙利-美国生物学家卡塔琳·考里科(Katalin Karikó)和美国科学家德鲁·韦斯曼(Drew Weissman),以表彰他们在mRNA疫苗技术方面作出的贡献。因他们在核苷酸碱基修饰方面的重要发现,人类得以用前所未有的速度快速开发出抗击新冠病毒的mRNA疫苗。两位科学家将分享1100万瑞典克朗奖金(约合732万元人民币),奖金数额相比去年增加了100万瑞典克朗。
如何看待mRNA疫苗的科学成就?为什么它可以在抗击新冠中“一战成名”?这一创新技术路线还能为人类健康带来什么?昨天,诺贝尔生理学或医学奖公布后,记者就这些公众关心的热点问题采访了相关领域专家。
因突破性发现,两位科学家被誉为“新冠功臣”
对科学界来说,今年诺贝尔生理学或医学奖的结果并非“非常意外”。2021年,考里科和韦斯曼就荣获了拉斯克临床医学研究奖,而该奖历来有“诺奖风向标”之称。公开资料显示,两人的研究工作为多家知名医药企业的mRNA疫苗研制奠定了基础。
相比其他疫苗研发技术路线,mRNA研究到底有何过人之处?上海合成免疫工程技术研究中心主任、复旦大学基础医学院教授应天雷告诉记者,传统的疫苗研发路线以病毒、蛋白质为基础,工艺较为复杂,比如制备灭活病毒疫苗,需要首先培养病毒,而后经历更多较为复杂的技术步骤。相比之下,通过mRNA技术路线研发疫苗,可直接递送核酸,将原本可能需要几个月的研发周期一下子缩短到几周。简言之,通过mRNA技术研发疫苗,就是一个字——“快”!而这一点,在应对、控制突发大规模人群传染病时是非常重要的。
也因此,两位科学家被誉为“新冠功臣”。简单说,他们发明了降低mRNA免疫原性的方法。他们开发的新平台使用经过核苷修饰可逃脱免疫系统的mRNA,克服了合成mRNA会被先天性免疫系统辨识而引发严重发炎反应的问题,并借由脂质纳米颗粒的包裹保护,将mRNA有效送入人体细胞,由其自行产生病毒的棘蛋白,进而诱发B细胞产生中和抗体、训练T细胞攻击受感染的细胞等一系列适应性免疫反应。
用于多种疾病防治,科学界对mRNA期待更多
那么,随着全球逐渐走出新冠疫情,是否意味着mRNA研究将就此打住?并非如此!多名科研人员昨天接受采访时表示,mRNA研究热有望进一步开启。
有研究人员称,mRNA技术路线的意义就在于,作为一种储备研究技术,它有助于帮助人类在面对突发传染病时快速制备出相应的疫苗。不止于传染病领域,有观点认为:“这些技术不仅彻底改变了疫苗学,更是蛋白质疗法的典范转移,未来还可应用在其他病毒疫苗、个人化精准癌症治疗、人类免疫缺陷,甚至罕见病等疾病领域。”
在全球,这一研究领域当属时下热门。“除了新冠,流感、艾滋、肿瘤等疾病领域,也试图利用这个技术路线开发相关预防性的疫苗,以及治疗用的创新药物。”应天雷告诉记者,在复旦大学上海医学院,已有不少科研人员投入mRNA方向的研究。
就在今年9月,上海交通大学药学院教授章雪晴团队也相继报道了有关mRNA的两项研究工作。深耕靶向mRNA递送系统研究逾10年,章雪晴告诉记者,与当前mRNA技术研究领域的火热不同,她入行之初,整个mRNA研究领域尚处于“冷板凳”时期,一度不被看好。“因此,当得知为mRNA疫苗快速研发奠定基础的两位科学家斩获今年的诺贝尔生理学或医学奖时,我们作为相关领域的研究者也倍感振奋。”据章雪晴介绍,眼下,以mRNA为代表的核酸生物技术在更广泛的疾病治疗领域被寄予厚望。不过,核酸药物作为一种外源药物,其进入人体内发挥作用还需要克服多重阻碍,包括不稳定性、免疫原性、靶向效率差、内涵体/溶酶体逃逸难、转染效率低等,这些也是该领域的研发核心。
复印机旁的友谊,成就“冷板凳”迎来聚光灯的传奇
今年的诺贝尔生理学或医学奖背后也包裹着一个励志的故事,两位获奖者的科研人生被反复提及。尤其是考里科,她对mRNA进行了持续40年左右的研究,曾一度被科学界认为是“走在一个无聊的死胡同里”。
考里科1955年出生在匈牙利的东部小镇,1972年考入塞格德大学,这是匈牙利最著名的大学之一。1985年,她与丈夫及2岁的女儿从匈牙利搬到美国。然而,等待她的是一条无比坎坷的学术道路。1990年,考里科第一次为mRNA项目申请科研经费,结果被拒。1995年,由于她接连申请不到科研基金,宾夕法尼亚大学医学院要将她“扫地出门”。与此同时,她还被诊断出患有癌症。最后,她不得不接受宾夕法尼亚大学对她降职、降薪的要求,这才得以留任。
直到1997年,考里科在宾夕法尼亚大学医学院的公共复印机旁,遇到了刚加入医学院的新教员、38岁的韦斯曼。韦斯曼1959年出生在美国,他的大部分研究经历投入传染性疾病领域,尤其对艾滋和流感这两种传染病感兴趣。两人开始攀谈并介绍自己的研究,复印机旁的友谊成就了一段佳话:彼此成为对方最重要的科研伙伴。两人由此开启的合作之路,将考里科又一次从困境中解救出来。因为,如果没有科研经费以及实验室的接纳,考里科可能再次面临“扫地出门”的危机。2005年,两位科学家发现通过修改RNA基因序列中的单个碱基,可以让其不会产生炎症,这一重要成果发表在知名学术期刊《免疫学》上,对推动mRNA应用产生了里程碑意义。
然而,此后的很长一段时间里,两人依然籍籍无名。直到2020年初,新冠疫情在全球暴发,mRNA疫苗横空出世,这对科研伙伴也从幕后走向台前,“冷板凳”迎来聚光灯。
“到底哪些研究是重要的,我们没办法由当下的结果来推导。科学世界固然充满着偶然、意外,但专注科学探索的过程、追逐好奇心的兴趣、孜孜以求的投入等科学精神,始终令人敬佩,值得学习。”一名科研人员谈及本年度诺奖首个揭晓奖项时,这样对记者说。
mRNA 技术突破了人类免疫系统对外来核酸的识别和消除
长期以来,mRNA 作为疫苗的研究,因为受到分子的不稳定性、免疫刺激不足和mRNA 递送时的低表达水平的阻碍而进展缓慢。幸好科学家们没有因此放弃,经过20多年的时间,将上述难题逐一攻克了。
对于mRNA分子的不稳定性,这个问题是最早被搞定的。科学家们认识到,RNA之所以不稳定,是因为我们的环境中存在大量可以分解RNA的酶RNase,只要防止接触RNase,或者通过试剂消除容器中的RNase,RNA 反而是一种相对稳定的物质。并且可以以冻干形式在环境温度下长期储存,极大地促进了分配和储存 。
第二个难题是不能产生足够的免疫反应,这个问题是最致命的,如果解决不好,mRNA疫苗的研发就会前功尽弃。
科学家们将最初在实验室设计合成得到的mRNA疫苗进行动物实验时,发现这些mRNA在小鼠身上不能产生任何设想中的免疫反应,也就是说疫苗没有发挥作用。这是什么原因呢?经过反复深入的研究,科学家们才发现原来小鼠免疫系统将mRNA当做了外来物,直接发起免疫反应将mRNA给清理掉。这对于之前信心满满的科学家是当头一棒。
来自匈牙利生物化学家宾夕法尼亚大学的卡塔林·卡里科(Katalin Karikó)致力于开发利用mRNA进行治疗的方法。她与免疫学家德鲁·维斯曼(Drew Weissman)就这个难题开展了卓有成效的合作,找到mRNA的“致命弱点”。并通过mRNA修饰技术,成功解决了这一难题。
他们发现哺乳动物细胞RNA中的碱基经常被化学修饰,而在试管内转录的mRNA不是。他们想知道是否缺乏改变的碱基在试管内转录的RNA可以解释不必要的炎症反应。为了研究这一点,他们产生了不同的mRNA变体,每种变体的碱基都有独特的化学变化,然后将它们传递给树突细胞。结果是惊人的:当mRNA中包含碱基修饰时,炎症反应几乎消失。
他们证明,mRNA之所以能引起宿主的免疫反应,关键在于一种叫做尿嘧啶的核苷酸。如果能修改其核苷部分,创造一个假尿嘧啶代替原来成分,就能大大降低树突状细胞识别出该mRNA的可能性,从而躲避免疫应答。这是我们对细胞如何识别不同形式的mRNA并对其做出反应的理解的范式转变。卡里科和维斯曼立即意识到他们的发现对使用mRNA作为治疗手段具有深远的意义。
他们的研究发表于2005年,比新冠疫苗的研发足足早了15年。这一难题的解决也就是卡里科和维斯曼此次荣获诺贝尔生理学或医学奖的原因。

卡里科和维斯曼通过mRNA修饰技术解决了mRNA被宿主固有免疫识别和清除的难题
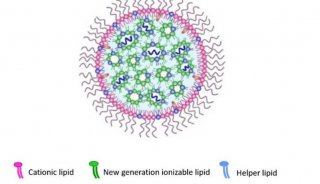
此外,另一个难题也有待解决。理论上mRNA无所不能,但很难进入临床研究,很大一个原因是mRNA进入人体非常低效,也就是缺乏一种有效的载体帮助mRNA进入细胞。2015年科学家将mRNA制成微小脂肪粒,称为脂质纳米颗粒(Lipid Nanoparticles, LNPs),以提高稳定性并使其更容易进入细胞,显著改善了mRNA疫苗的信息传递效率。

LNP显著改善了mRNA疫苗的传递效率
脂质纳米颗粒具有较好的生物相容性和生物降解性。纳米药物最显着的特性是高表面积体积比,这实现了高效的药物包装。封装的药物受到保护,免于降解和免疫清除,并且由于有效的药物包装,可以大大降低给药剂量。当然,LNP还是有一定的反应原性,可能会造成接种者大概100万分之几的比例出现严重的过敏症状,技术上有进一步改进的空间。
至此,mRNA疫苗卡脖子的难题被逐一突破,全新的mRNA疫苗呼之欲出。