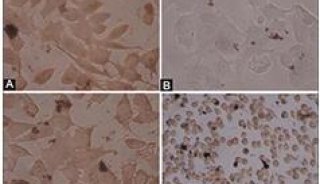
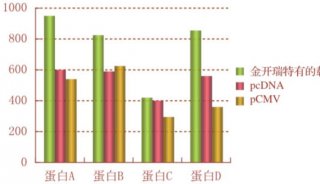
未正确折叠蛋白介导的细胞凋亡
在真核生物体内,为正确折叠蛋白反应(unfolded protein response,UPR)是细胞对抗内质网应激的一种重要的自我保护机制。当细胞中出现长时间或高强度的UPR时,三种内质网上的跨膜蛋白PERK、IREI、ATF6在发挥修复作用的同时,也可以同时启动由ERS介导的三种细胞凋亡途径。
PERK信号通路
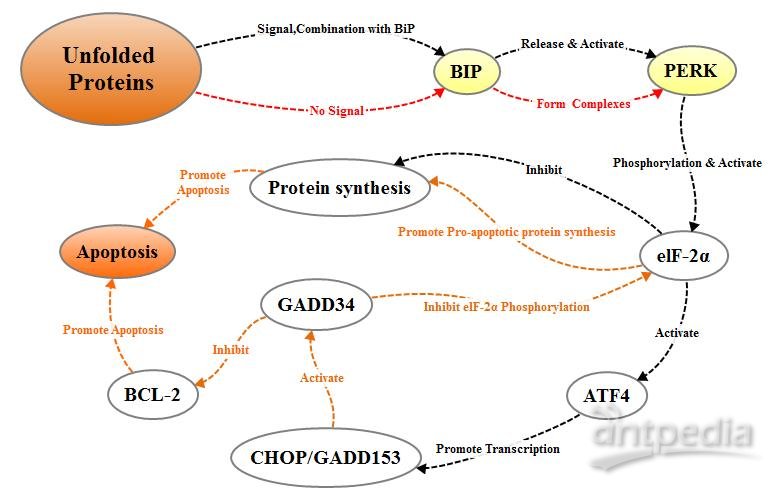
PERK是分布于内质网膜上的一种蛋白激酶。当蛋白正常折叠时,其与分子伴侣如BIP/GRP78相结合形成稳定的复合物;当有蛋白未正常折叠时,未正确折叠的蛋白与BIP/GRP78相结合,竞争性干扰 Bip/Grp78与PERK的相互作用。释放的PERK通过低聚化和反向自身磷酸化的方式被活化,活化的PERK可以使翻译起始因子2的α亚单位(eIF-2α)磷酸化。在应激反应的早期磷酸化的eIF2α抑制蛋白质的翻译与合成,减轻内质网中蛋白折叠的负荷量,从而对细胞起到保护作用;随着应激反应时间和强度的增加,磷酸化的eIF-2α诱导激活转录因子ATF4的转录表达,ATF4可以促进凋亡信号分子CHOP/ GADD153的表达,进而促进细胞凋亡。
IREI信号通路
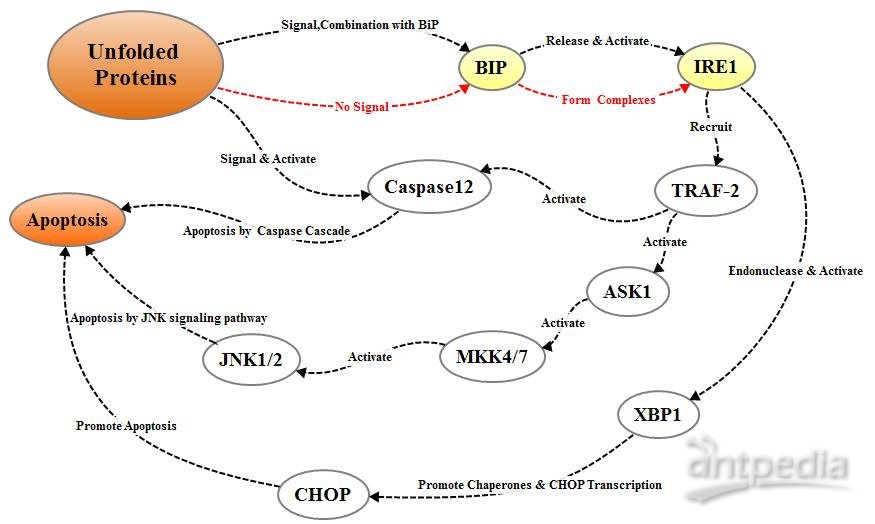
IREI是分布于内质网膜上的另一种蛋白激酶。该信号通路的激活方式与PERK的激活方式相同。当未正常折叠蛋白在内质网中累积时,IREI-BIP/GRP78复合物解离,释放的IREI寡聚化和反向自身磷酸化后被激活;激活的IREI可以传导细胞存活信号和细胞凋亡信号。在凋亡的过程中,激活的IRE1招募胞浆调节蛋白TRAF-2,间接招募和激活c—Jun N端激酶,激活的c—Jun N端激酶通过磷酸化抑制Bcl-2家族中抑制凋亡蛋白的活性,促进蛋白凋亡;另一方面激活的TRAF-2同时激活Caspase12,启动Caspase级联反应,介导细胞凋亡;此外IRE1还具有核糖核酸酶活性,切割XBP1mRNA,促进XBP1mRNA成熟,增强分子伴侣蛋白和CHO的转录表达,从而促进细胞凋亡。
ATF6信号通路
ATF6是内质网膜上的II型跨膜蛋白。ATF6的N端胞内区域包含了b-ZIP的DNA转录激活域和核定位信号。在非应激状态下,以酶原的形式分布于内质网膜上。当在内质网应激状态下,ATF6以囊泡的方式向高尔基体转移。在高尔基体中被S1P 和S2P剪切激活,然后再核定位信号的牵引下迁移至细胞核,在细胞核中诱导包括CHOP/ GADD153在内的内质网应激基因的转录表达。

PERK、IRE1、ATF6三条信号通路均可对诱导产生CHOP/GADD153,CHOP/GADD153的激活是内质网应激反应的直接结果,CHOP/GADD153在生长停止和细胞死亡中起到重要作用。