流式细胞分析
实验概要
流式细胞分析是指通过对细胞进行免疫荧光染色,经过流式细胞仪分选荧光细胞或分析荧光细胞所占总体细胞的比例。流式细胞分析可以检测细胞周期分布、细胞亚群等,是一种强大的实验工具。
流式细胞分析操作过程视实验目的而定,下面以碘化丙啶(Propidium Iodide,PI)染色法流式细胞技术分析细胞周期为例介绍。
实验原理
细胞DNA在细胞周期中会进行复制和分裂,随着细胞周期的进行,单个细胞中的DNA含量会发生相应的变化。PI可以插入DNA和RNA的碱基对中,使用时需用RNase处理细胞,以排除RNA对DNA荧光定量精度的影响。通过流式细胞技术分析细胞群的PI的荧光分布,从而分析DNA含量的分布,进而分析细胞周期的分布。
主要试剂
0.25%Trypsin、细胞基础培养液、DPBS、70%酒精、5mg/mL RNase溶液、100μg/mLPI染液
主要设备
300目尼龙滤膜、15 mL离心管、流式管
实验步骤
(1)消化。从培养箱中拿出待染色的细胞,弃去培养液,用DPBS洗两次,接着用0.25%Trypsin消化4 min,用Trypsin2倍体积细胞基础培养液。收集细胞悬液至15 mL离心管,1000 r/min离心5min,弃上清。
(2)洗涤。用DPBS液洗一遍,1000 r/min离心5min,弃上清。
(3)固定。缓慢加入-20℃预冷的70%酒精7.5mL,冰浴30min(可以过夜,第二天染色)。
(4)PI单染。用移液器将固定的细胞吹散,用300目尼龙滤膜过滤,收集滤液在15
mL离心管中,1000 r/min离心5min,弃上清。加100μL 5mg/mL
RNASE溶液,37℃孵育30min,然后冰浴终止酶作用。加100μg/mL
PI染液,室温避光染色30min。之后可以根据细胞悬液的浓度适当补充细胞培养液或DPBS,用300目尼龙滤膜过滤,收集滤液到流式管中,随后进行流式细胞检测分析。
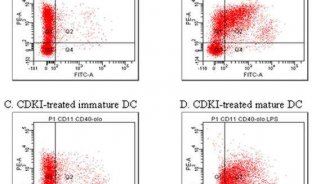
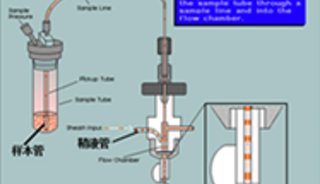
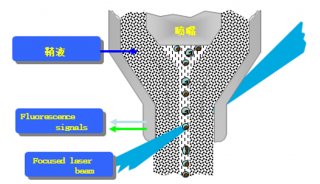
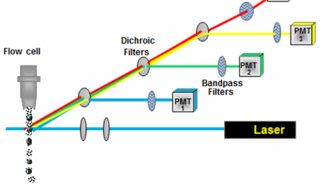
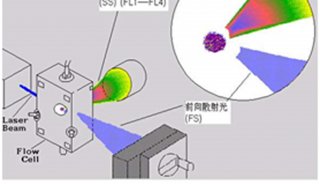
(5)根据PI的激发光波长为488nm,最大发射波长为610-620nm,来选择所需要的激光器和收集发射波的荧光通道,然后通过调节液路和光路,使得激发光正好打在液流上且聚焦良好。同时在计算机显示器上设置好程序并绘制好所需要的直方图。仪器状态和计算机显示器就绪后,将收集好滤液的流式管放到上样管位置,开始上样检测。流式不但能检测出荧光强度,同时还能时时的显示出各种荧光强度下的细胞数目。
(6)利用流式细胞仪测细胞周期。
图中横坐标显示的是荧光强度相关参数,纵坐标显示的是每个荧光强度所对应的细胞数目,图中可以清楚地显示出G1期,S期,G2/M期的峰,可以对各种荧光强度的细胞进行“设门”,可得到门内细胞数目、门内细胞的百分比、占检测细胞总数的百分比等,通过分析各峰的细胞百分比,得出处在各时期的细胞比例