强生EGFR-MET双特异性抗体疗法获美国FDA突破性药物资格!
强生(JNJ)旗下杨森制药近日宣布,美国食品和药物管理局(FDA)已授予JNJ-61186372(JNJ-6372)突破性药物资格(BTD),用于治疗接受含铂化疗后病情进展、表皮生长因子受体(EGFR)第20号外显子有插入突变的转移性非小细胞肺癌(NSCLC)患者。

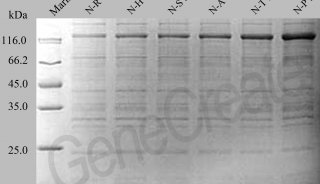
JNJ-6372是一种具有免疫细胞导向活性的EGFR-间质表皮转化因子(MET)双特异性抗体,靶向激活和耐药EGFR及MET突变及扩增。该药是强生与丹麦Genmab公司合作基于DuoBody平台研发。目前,针对EGFR第20号外显子有插入突变的肺癌患者,尚无FDA批准的靶向疗法。
EGFR第20号外显子有插入突变的非小细胞肺癌(NSCLC)患者,通常对EGFR受体酪氨酸激酶抑制剂(TKI)治疗不敏感,与更常见的EGFR突变(19号外显子缺失/L858R替代)的患者相比,预后更差。目前,这类患者群体的护理标准是常规细胞毒性化疗。
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病、并且有初步临床证据表明该药与现有治疗药物相比能够实质性改善病情的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。
此次BTD,基于一项首个人体、开放标签、多中心I期研究(NCT02609776)的数据。该研究在晚期NSCLC成人患者中开展,评估了JNJ-6372单药疗法、JNJ-6372与新型第三代EGFR TKI联合用药的初步疗效、安全性和药代动力学。这项研究旨在确定晚期NSCLC患者的推荐II期临床剂量,目前第二部分剂量扩展队列正在入组患者,以评估JNJ-6372单药治疗在携带基因组改变的多个NSCLC亚组中的活性,如C797S耐药突变或MET扩增。
杨森研发公司肿瘤学全球治疗区域负责人Peter Lebowitz博士表示:“JNJ-6372是一种新颖的双特异性抗体,我们相信它有潜力使那些对目前可用的口服EGFR靶向疗法或免疫检查点抑制剂疗法治疗无效、EGFR第20号外显子有插入突变的肺癌患者受益。此次突破性药物资格认定,是我们不断努力推进JNJ-6372临床开发以及靶向基因定义肺癌方面的一个重要里程碑。”