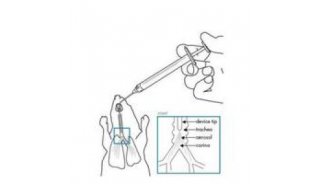
强生双特异性抗体再获FDA批准 每两周给药一次
近日,强生公司宣布,美国FDA已批准TECVAYLI的补充生物制品许可申请(sBLA),用于治疗复发性或难治性多发性骨髓瘤患者。治疗方案允许在至少六个月内达到并维持完全缓解或更好的疗效,而给药频率则降低为每两周1.5mg/kg(Q2W)。
这次FDA的批准为适用于基于体重的治疗方案的患者提供了更灵活的给药选择。TECVAYLI的批准将使医生和患者能够根据个体化的治疗需求,制定更适合的治疗计划。
该批准主要基于MajesTEC-1临床1/2期试验的结果。在该研究中,患者最初接受每周一次推荐的2期剂量(RP2D,1.5 mg/kg)Tecvayli的皮下注射治疗。当患者达到确认CR达六个月以上时,则有资格将给药频率减少至每两周一次(1.5 mg/kg),直到疾病进展或出现不可接受的毒性。
之前所公布的MajesTEC-1试验积极结果数据显示,在165名接受每周皮下注射teclistamab的RRMM患者中,总缓解率达到63%,值得一提的是,58.8%的患者获得非常好的部分缓解(VGPR)以上的应答,39.4%的患者获得完全缓解(CR)以上的应答。
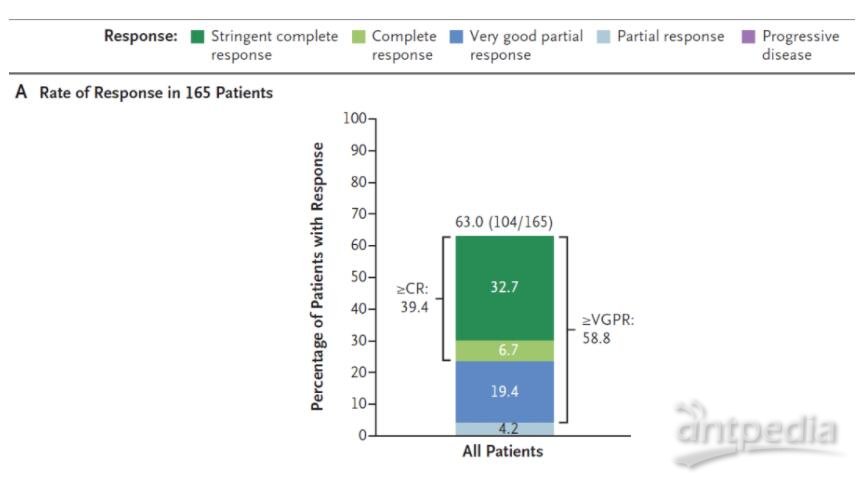
Teclistamab在MajesTEC-1试验中的缓解率数据
TECVAYLI 是世界范围内第一个被批准用于治疗多发性骨髓瘤 (MM) 的双特异性抗体疗法 (BCMAxCD3)。
这是一款首创的(first-in-class)BCMAxCD3 双特异性 T 细胞结合抗体,能够靶向结合 T 细胞表面表达的 CD3 受体以及多发性骨髓瘤 (MM) 细胞和一些健康 B 细胞表面表达的 B 细胞成熟抗原(BCMA)。CD3 参与激活 T细胞,BCMA 在 MM 细胞上表达水平显著升高。TECVAYLI 将 CD3 阳性 T 细胞重新定向到表达 BCMA 的 MM 细胞,以诱导针对靶细胞的细胞毒作用。
该药物于2022年10月获得FDA加速批准,用于治疗先前至少接受过四种疗法的复发性或难治性多发性骨髓瘤成人患者。该公司表示,该药物的持续批准可能取决于验证性研究中对临床益处的验证和描述。
该批准得到了1/2期MajesTEC-1研究(NCT03145181;NCT04557098)结果的支持,其中患者最初每周接受推荐的2期剂量(RP2D) teclistamab1.5mg/kg。在第2阶段持续6个月或更长时间达到完全缓解或更好的患者有资格接受每2周1.5mg/kg的减少剂量的药物治疗,直到出现不可接受的毒性或疾病进展。
这项临床试验的结果在《新英格兰医学杂志》上发表。试验结果显示患者获得深度和持久的缓解。中位缓解持续时间达到18.4个月,中位无进展生存期为11.3个月,中位总生存期为18.3个月。