细菌质粒 DNA 的小量制备
实验方法原理
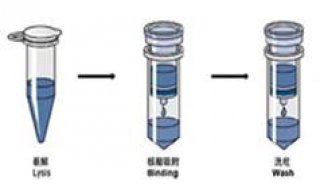
由于大肠杆菌染色体 DNA 比通常用作载体的质粒 DNA 分子大得多,因此在提取过程中,染色体 DNA 易断裂成线型 DNA 分子,而大多数质粒 DNA 则是共价闭环型,根据这一差异便可以设计出各种分离、提纯质粒 DNA 的方法。碱裂解法就是基于线型的大分子染色体 DNA 与小分子环型质粒 DNA 的变性复性之差异而达到分离目的。在 pH 12.0~12.6 的碱性环境中,线型染色体 DNA 和环型质粒 DNA 氢键均发生断裂,双链解开而变性,但质粒 DNA 由于其闭合环型结构,氢键只发生部分断裂,而且其二条互补链不会完全分离,当将 pH 调至中性并在高盐浓度存在的条件下,已分开的染色体 DNA 互补链不能复性而交联形成不溶性网状结构,通过离心大部分染色体 DNA、不稳定的大分子 RNA 和蛋白质-SDS 复合物等一起沉淀下来而被除去。而部分变性的闭合环型质粒 DNA 在中性条件下很快复性,恢复到原来的构型,呈可溶性状态保存在溶液中,离心后的上清中便含有所需要的质粒 DNA,再通过用酚、氯仿抽提,乙醇沉淀等步骤而获得纯的质粒 DNA。
实验材料 大肠杆菌
试剂、试剂盒 含氨苄青霉素(Amp)的 LB 液体培养基固体培养基溶液ⅠⅡⅢ和ⅣTE 缓冲液无DNase 的 RNase冷乙醇TAE 缓冲液琼脂糖凝胶凝胶加样缓冲液溴化乙锭氨苄靑霉素水溶液
仪器、耗材 稳压电泳仪水平式微型电泳槽透射式紫外分析仪旋涡混合器微量加样器
实验步骤
1. 挑取大肠杆菌 TGI/pUC18 的一个单菌落于盛 5 ml LB 培养基的试管中(含 100 ug/ml 的氨苄青霉素),37 ℃ 振荡培养过夜(约 16~24 h)。
2. 吸取 1.5 ml 的过夜培养物于一小塑料离心管(又称 Eppendorf 管)中,离心(12000 r/min,30 s)后,弃去上清,留下细胞沉淀。
离心可在 4℃ 或室温(25℃~28℃)下进行,离心时间不可太长,以免影响下一步菌体的分散悬浮。
3. 加入 100 ul 冰预冷的溶液 Ⅰ,在旋涡混合器上强烈振荡混匀。
要确保细胞被完全悬浮,使细胞最大数量地接触下一步的溶液 Ⅱ,达到完全裂解,以提高质粒的质量。
4. 加入 200 ul 溶液 Ⅱ,盖严管盖,反复顛倒小离心管 5~6 次或用手指弹动小管数次,以混合内容物。置冰溶中 3~5 min(根据不同菌株,可适当缩短)。
5. 加入 150 ul 溶液 Ⅲ,在旋涡混合器上快速短时(约 2 s)振荡混匀,或将管盖朝下温和振荡10 s,置冰溶 3~5 min。
确保完全混匀,又不致使染色体 DNA 断裂成小片段。
6. 离心(12000 r/min)5 min,以沉淀细胞碎片和染色体 DNA。取上清转移至另一沽净的小离心管中。
7. 加入等体积的溶液 Ⅳ 振荡混匀,室溫下离心 2 min,小心吸取上层水相至另一洁净小离心管中。
8. 加入 2 倍体积的冷无水乙醇,置室温下 2 min 以沉淀核酸。
9. 室温下离心 5 min,弃上清。加入 1 ml 70% 乙醇振荡漂洗沉淀。
10. 离心后,弃上清,可见 DNA 沉淀附在离心管管壁上,用记号笔标记其位置,并用消毒的滤纸小条小心吸净管壁上残留的乙醇,将管倒置放在滤纸上,室溫下蒸发痕量乙醇 0~15 min,或真空抽干乙醇 2 min,也可在 65 ℃ 烘箱中干燥 2 min。
11. 加入 50 ul TE 缓冲液(含 RNase,20 ug/ml)充分混匀,取 5 ul 进行琼脂糖凝胶电泳,剩下的贮存於-20 ℃ 冰箱内,为下一个实验用。
用加入的 50 ul TE 缓冲液多次,反复地洗涤 DNA 沉淀标记部位,以充分溶解附在上的质粒 DNA。
12. 琼脂糖凝胶电泳观察质粒 DNA
12.1 将微型电泳槽的胶板二端挡板插上,在其一端放好梳子,在梳子的底部与电泳槽底板之间保持约 0.5 mm 的距离。
12.2 用电泳缓冲液配制 0.7% 的琼脂糖胶,加热使其完全溶化,加入一小滴溴化乙锭溶液(1 mg/ml),使胶呈微红色,摇匀(但不要产生气泡冷至 65 ℃ 左右,倒胶(凝胶厚度一般为 0.3~0.5 cm)。倒胶之前先用琼脂糖封好电泳胶板二端挡板与其底板的连接处,以免漏胶。
根据实验需要,溴化乙锭溶液也可不直接加入胶中,而是在电泳完毕后,将凝胶放在含 0.5 mg/ml 的 EB 中染色 15~30 min,然后转入蒸馏水中脱色 15~30 min。
12.3 待胶完全凝固后,小心取出二端挡板和梳子,将载有凝胶的电泳胶板(或直接将凝胶)放入电泳槽的平台上,加电泳缓冲液,使其刚好浸没胶面(液面约离出胶面 1 mm)。
12.4 取上述获得的质粒 DNA 3~5 ul 加 1~2 ul 加样缓冲液(内含溴酿蓝指示剂),混匀后上样。
12.5 接通电源,记住:上样槽一端位于负极,电压降选择为 1~5V/cm(长度以两个电极之间的距离计算)。
12.6 根据指示剂迁移的位置,判断是否中止电泳。切断电源后,再取出凝胶,置紫外透射仪上观察结果或拍照。
EB 特异性地插入质粒 DNA 分子后,因为同一种质粒的相对分子质最大小一致,因此在凝胶中形成一条整齐的荧光带而有别子染色体荧光带。
注意事项
不要强烈振荡,以免染色体 DNA 断裂成小的片段而不易与质粒 DNA 分开。