Nature | 破解领域难题:BRCA1如何被募到DNA双链断裂位点?
同源末端重组 (HR) 和非同源末端重组 (NHEJ) 是细胞遭受DNA双链断裂 (DSBs) 之后进行损伤修复的两个重要武器,并分别由各自通路中的关键蛋白BRCA1 (HR) 和53BP1 (NHEJ) 所介导。它们的相同之处在于,BRCA1和53BP1都需要同时结合在H2AK15ub (由泛素E3连接酶RNF168催化) 和H4K20这两个位点而被招募到损伤位点;不同的是,53BP结合H4K20位点需要携带甲基化修饰(H4K20me1和H4K20me2),而BRCA1则识别非甲基化的H4K20 (H4K20me0),这种表观状态只会在DNA复制期间 (G1期) 出现在新合成的组蛋白上。因此,HR和NHEJ通常各司其职,并在不同的细胞周期中各自发挥功能【1,2】。
现在已知的是,53BP1会分别通过其TTD (tandem-Tudor domain) 和UDR (ubiquitin-dependent recruitment)结构域来识别H2AK15ub和H4K20me1/2位点【3】,而BRCA1则会通过其伴侣蛋白BARD1与非甲基化的H4K20结合【4】,至于BRCA1是如何识别H2AK15ub位点?这个问题一直困扰着学界。
2021年7月28日,来自牛津大学韦瑟尔分子医学研究所的J. Ross Chapman研究团队在Nature上发表了题为 BARD1 reads H2A lysine 15 ubiquitination to direct homologous recombination的研究文章,揭示了BRCA1被招募到DNA 双链断裂位点的具体分子机制,破解了该领域长期悬而未决的难题。
图片
首先,作者推测BRCA1 -BARD1复合体可能是通过BARD1与H2AK15ub结合,于是作者通过单个氨基酸位点突变和表型筛选,鉴定到BRCT结构域上R705, D712, Q715可能是结合的关键位点 (BARD1蛋白包含一个N端RING结构域、中间的ARD结构和C端两个串联的BRCT结构域, 如图1),并且这三个氨基酸之间会形成一段结构保守的loop。进一步,他们发现ARD结构域与这三个位点的功能相互关联。这些结果提示,BRCT与ARD结构域可能共同参与了BRCA1-BARD1复合体与组蛋白的结合。
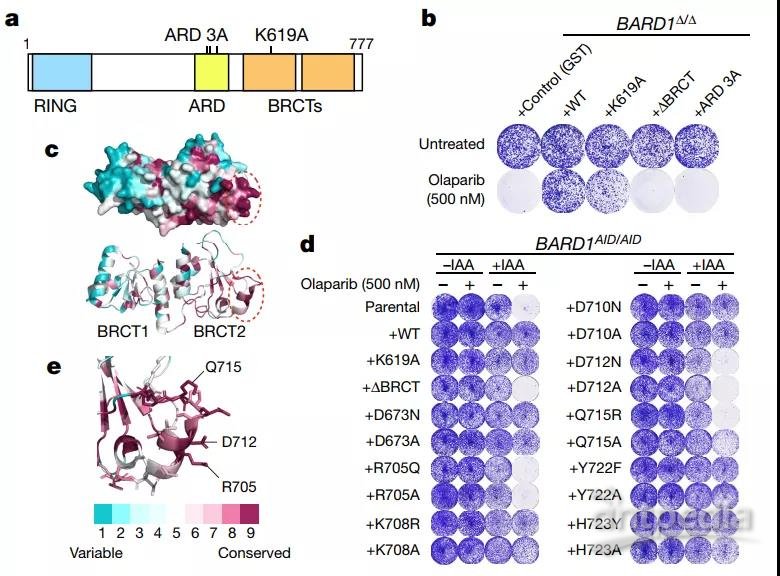
图1 通过结构分析、点突变和表型筛选寻找BARD1结合组蛋白的关键位点
为了找到BRCT结合H2AK15ub位点的直接证据,作者进行了体外pull-down实验。借助体外pull-down,他们证明BRCT的确可以在ARD协同下特异性地与H2AK15ub位点结合,并且BRCT只会结合H4K20非甲基化修饰的染色质。为了与53BP1蛋白的UDR结构域保持一致,他们将BRCT三个关键氨基酸所形成的loop命运为BUDR结构域。至此,作者已经找到了BRCA1 -BARD1复合体识别H2AK15ub位点的关键结构域。
最后,作者展开了细胞功能验证,并且作者证明BRAD1识别双链断裂位点是由RNF158催化的H2AK15ub所介导。考虑到H2AK15ub同样会招募53BP1到达损伤位点,为了使两者的功能不会“起冲突”,作者推测BRAD1可能会通过某种机制去抑制53BP1通路的激活。作者发现在BRAD1Δ/Δ细胞中,BRCA1下游的效应蛋白RAD51不能识别损伤信号,而在53BP1-/ -BRAD1Δ/Δ细胞中则又可以被招募至损伤位点,这说明抑制53BP1介导的NHEJ会增强HR的功能。但是HR的修复能力却并没有被完全恢复,有趣的是,在53BP1-/ -BRAD1Δ/Δ细胞中回补野生型以及与染色质结合功能缺失的BRAD1都可以恢复HR的全部功能,这说明BRCA1 -BARD1复合体会存在一种不依赖BARD1与染色质结合的方式被招募到损伤位点。
总结一下:这项研究实际上回答了围绕DNA双链断裂修复通路的两个长期未被回答的科学问题:第一,DNA损伤产生的H2AK15ub信号是如何招募BRCA1-BRAD1到达损伤位点;第二,该复合体在介导同源末端重组修复的同时如何抑制53BP1介导的非同源末端重组 (模式图)。这一发现让我们对于DNA损伤修复通路有了新的认识。
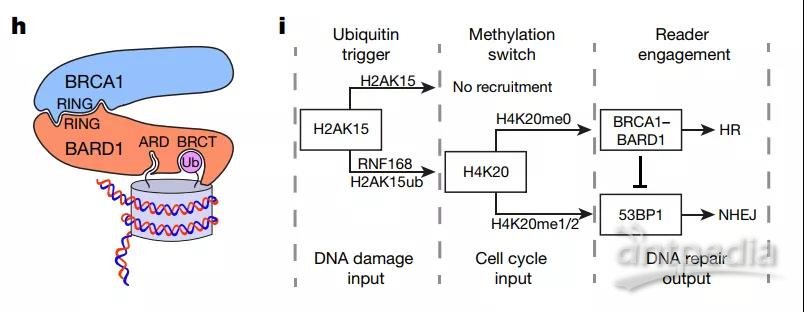
模式图
参考文献
1. Doil, C. et al. RNF168 binds and amplifies ubiquitin conjugates on damaged chromosomes to allow accumulation of repair proteins. Cell 136, 435–446 (2009).
2. Stewart, G. S. et al. The RIDDLE syndrome protein mediates a ubiquitin-dependent signaling cascade at sites of DNA damage. Cell 136, 420–434 (2009).
3. Botuyan, M. V. et al. Structural basis for the methylation state-specific recognition of histone H4-K20 by 53BP1 and Crb2 in DNA repair. Cell 127, 1361–1373 (2006).
4. Nakamura, K. et al. H4K20me0 recognition by BRCA1–BARD1 directs homologous recombination to sister chromatids. Nat. Cell Biol. 21, 311–318 (2019)
-
科技前沿

-
精英视角