反义RNA药物Tegsedi获欧盟CHMP支持批准 治疗hATTR淀粉样变性
Ionis制药公司是反义RNA疗法方面的行业领导者,已利用其专有的反义RNA技术,创建了一个庞大的首创或同类最佳的药物管线,在研药物超过40种,并与多个行业巨头达成了战略合作,包括:罗氏、诺华、葛兰素史克、阿斯利康、百健等。目前,Ionis公司已有2个反义RNA药物上市,分别为Kynamro(mipomersen)和Spinraza(nusinersen);前者用于治疗纯合子家族性高胆固醇血症(HoFH),后者用于治疗脊髓性肌萎缩症(SMA)。此外,Ionis公司还有2款反义RNA药物Tegsedi(inotersen)和Waylivra(volanesorsen)已成功完成III期临床,目前正在接受美国和欧盟的监管审查。

近日,Tegsedi在欧盟监管方面就传来了好消息。欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极意见,推荐批准Tegsedi用于遗传性转甲状腺素蛋白(hATTR)淀粉样变性成人患者第1或第2阶段多发性神经病变的治疗。欧盟委员会(EC)在做出最终审查决定时,通常都会采纳CHMP的建议,这也意味着Tegsedi极有可能在未来2-3个月获批上市,造福欧洲的hATTR患者。
CHMP支持批准Tegsedi,是基于III期临床研究NEURO-TTR的数据以及在具有多发性神经病症状的hATTR淀粉样变性患者中开展的开放标签扩展研究的数据。来自NEURO-TTR研究的结果表明,与安慰剂组相比,Tegsedi治疗组在共同主要终点方面获得了显著的治疗受益:诺福克生活质量-糖尿病神经病变(Norfolk QOL-DN)问卷评估的患者生活质量,以及改良神经病变损伤评分(mNIS+7)系统评估的神经病理性疾病进展。此外,Tegsedi治疗组转甲状腺素蛋白(TTR)水平显著降低。在研究期间,识别到了血小板减少和肾小球肾炎风险,加强监测被证明一种有效的措施,可用于支持这些问题的早期发现和管理。研究中,观察到的最常见的不良事件为注射部位反应。
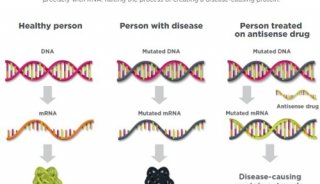
Tegsedi是一种反义核苷酸药物,可抑制TTR蛋白(包括突变型和野生型)的生成,TTR的异常形成和聚集导致TTR淀粉样沉积,这是hATTR淀粉样变性的根本原因。目前,Tegsedi正在接受美国、欧盟、加拿大的监管审查。在美国,FDA已授予Tegsedi孤儿药资格和快速通道地位。在欧盟,EMA已授予Tegsedi孤儿药资格。
hATTR是一种罕见的进展性、系统性、致死性遗传性神经疾病,是由于TTR淀粉样蛋白异常形成和聚集并沉积在全身多个器官和组织,包括周围神经、心脏、肠道、眼睛、肾脏、中枢神经系统、甲状腺和骨髓。在这些组织和器官中,TTR淀粉样沉积物的逐渐积累会导致感觉、运动和自主神经功能障碍,常常对患者生活的多个方面有致衰性作用。hATTR淀粉样变性患者常表现混合表型,并经历多发性神经病和心肌病的重叠症状。患有多发性神经病症状的hATTP患者分为3个阶段:第1阶段患者不需要步行辅助,第2阶段患者需要步行辅助,第3阶段患者依赖轮椅。
最终,hATTR淀粉样变性会在症状发作的3-15年内导致死亡。目前,hATTR淀粉样变性患者的治疗选择非常有限,还没有疾病修饰药物获批。据估计,在全球范围内,大约有5万例hATTR淀粉样变性患者。
-
焦点事件
-
产品技术










