细菌基因组DNA提取试剂使用说明(一)
细菌基因组DNA提取试剂使用说明书
◆ 产品说明
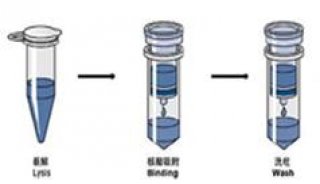
基于硅胶柱纯化方式。试剂中的溶菌酶消化去除细菌的细胞壁,革兰氏阳性细菌还可加入玻璃珠涡旋破壁,在裂解液和蛋白酶作用下裂解消化,DNA释放到裂解液中。加入乙醇后,转移至吸附柱中过滤,DNA被吸附至吸附柱的膜上,而蛋白质则被去除。吸附柱经Buffer GW2洗涤后去除其他杂质,最后通过低盐缓冲液(Buffer AE等)洗脱DNA,洗脱的DNA可直接用于恒温荧光法和荧光定量PCR检测等。
◆ 产品组成
071021M | |
成份 | 含量 |
吸附柱 | 48个 |
2ml收集管 | 48个 |
Buffer STE | 30 ml |
Buffer SDS | 2 ml |
Buffer DL | 30 ml |
Buffer GW2 | 20 ml |
Buffer AE | 6 ml |
Lysozyme | 100 mg |
Proteinase K | 24 mg |
Protease Dissolve Buffer | 2 ml |
说明书 | 1份 |
储存条件及有效期
Proteinase K干粉和Lysozyme为干粉状,常温运输,保存于2 - 8℃或-20℃,其他组分可在室温下保存,保质期为一年。低温状态下,Buffer SDS或有微量沉淀形成,需37℃下使其溶解。
自备材料
无水乙醇(≥96%);
离心管和吸头;
离心机;
水浴锅或金属浴
◆ 试剂配制
1)添加0.6ml Protease Dissolve Buffer至Proteinase K干粉中,颠倒混匀使蛋白酶K充分溶解,于-20℃保存。
2)添加2ml Protease Dissolve Buffer至Lysozyme管子中,颠倒混匀使溶菌酶充分溶解,于-20℃保存。
3)添加40 ml无水乙醇稀释Buffer GW2,于室温下保存。
◆ 使用方法
一. 革兰氏阴性细菌DNA提取
该方案适合于从﹤1.5 × 109个革兰氏阴性细菌中提取总DNA。细菌数量可以通过分光光度计进行测量。1OD600约为1.5 × 109个革兰氏阴性细菌。
转移0.5-1ml细菌培养液(<1.5 × 109个细菌)至1.5ml离心管中。10,000rpm离心1分钟收集细菌,倒弃培养液。
加入200µl Buffer STE、10µl Lysozyme和10µl Proteinase K至细菌沉淀团中。涡旋充分重悬细菌,37℃水浴10~30分钟。
加入220µl Buffer DL至细菌重悬液中。涡旋混匀,65℃水浴消化30分钟。
加入220µl无水乙醇至裂解液中。最高速度涡旋30秒。
注:这一步若有絮状沉淀出现,用移液枪吸打几次尽量打散沉淀。
把吸附柱Column装在2ml收集管中。把第4步获得的混合液(包括沉淀)转移至吸附柱中。10,000rpm离心1分钟。
注:若吸附柱出现堵塞,提高离心速度至13,000 rpm,离心3分钟。
倒弃滤液,把吸附柱装回收集管中。加入600µl Buffer GW2(已用乙醇稀释)至吸附柱中。10,000rpm离心1分钟。
注:Buffer GW2须用无水乙醇稀释,按瓶子标签或说明书指示进行稀释。
倒弃滤液,把吸附柱装回收集管中。再加入300µl Buffer GW2(已用乙醇稀释)至吸附柱中。10,000rpm离心3分钟。
将吸附柱装在新的1.5ml离心管中。加入30-50µl预热至65℃ Buffer AE至吸附柱膜中央。放置3分钟。10,000rpm离心1分钟。
9. 丢弃DNA结合柱,DNA保存于2-8℃,长期保存需保存于-20℃。
二. 革兰氏阳性细菌DNA提取
该方案适合于从﹤1.5 × 109革兰氏阳性细菌中提取总DNA。细菌数量可以通过分光光度计进行测量。1OD600约为1.5 × 109个革兰氏阳性细菌。革兰氏阳性细胞的细胞壁很厚,不能直接进行裂解。需通过溶菌酶消化去除细胞壁。革兰氏阴性细菌和大部分的革兰氏阳性细菌如杆菌,通过酶法处理就可达到良好的破壁效果。某些革兰氏阳性细菌因带有很厚的细菌壁,还需结合珠磨法才能达到效果。
酶法:采用溶菌酶(Lysozyme)消化细胞壁,把细菌转化为原生质体。葡萄珠菌属包有较厚的细胞壁,还需结合溶葡萄球菌素(Lysostaphin)一起消化。
珠磨联酶法:先采用溶菌酶消化细胞壁,然后采用酸洗玻璃珠(0.1-0.2mm)高速涡旋振荡使细菌发生裂解。处理葡萄球菌,粪脓球菌等裂解细菌时,加入玻璃珠涡旋能明显提高产量。
转移0.5-1ml细菌培养液(﹤1.5 × 109个细菌)至1.5ml离心管中。10,000rpm离心1分钟收集细菌,倒弃培养液。
注:若培养液密度比较大,离心速度和离心时间都可能需要提高,以保证细菌的充分沉淀收集。若需要从菌斑中提取DNA:用接种环刮下菌斑,按第2步进行操作,把菌斑转移至Buffer STE,涡旋混匀。
加入200µl Buffer STE和30µl Lysozyme至细菌沉淀团中。涡旋充分重悬细菌,37℃水浴30分钟。处理葡萄球菌属的细菌时,最好再加入1µl Lysostaphin(20mg/ml)。
加入15µl Buffer SDS和10µl Proteinase K至细菌重悬液中。涡旋混匀,65℃水浴消化30分钟。
室温下,10,000rpm离心3分钟。转移上清液至新的离心管中。
加入250µl Buffer DL和250µl无水乙醇至裂解液中。最高速度涡旋30秒。
注:这一步若有明显的絮状沉淀,用移液枪吸打几次尽量打散沉淀。
把吸附柱Column装在2ml收集管中。转移第5步获得的混合液(包括沉淀)至吸附柱中。10,000rpm离心1分钟。
注:若吸附柱出现堵塞,提高离心速度至13,000 rpm,离心3分钟。
倒弃滤液,把吸附柱装回收集管中。加入600 µl Buffer GW2(已用乙醇稀释)至吸附柱中。10,000rpm离心1分钟。
注:Buffer GW2须用无水乙醇稀释,按瓶子标签或说明书指示进行稀释。
倒弃滤液,把吸附柱装回收集管中。再加入300µl Buffer GW2(已用乙醇稀释)至吸附柱中。10,000rpm离心2分钟。
将吸附柱装在新的1.5ml离心管中。加入30-50µl预热至65ºC Buffer AE至吸附柱膜中央。放置3分钟。10,000rpm离心1分钟。
丢弃DNA结合柱,DNA保存于2-8℃,长期保存需保存于-20℃。