武大李红良教授同期发表两篇Nature Medicine文章
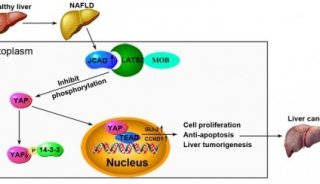
非酒精性脂肪性肝炎NAFLD是肝脏疾病的一种极端发展形式,在过去的20年里,NAFLD发病数已翻倍,目前已经成为西方国家中最为常见的肝脏疾病,在中国也越来越多。
李红良(Hongliang Li)教授十年前来到了武汉大学人民医院,从零开始创建实验室与科研团队,近年来其研究组致力于非酒精性脂肪肝病、肝脏代谢及相关疾病研究。已经在Nature Medicine等杂志上发表了多篇重要的成果。
12月14日的Nature Medicine同期发布了李红良教授研究组的两项成果,第一篇文章针对ASK1这个具有治疗前景的临床前药物靶点,寻找到了新的非酒精性脂肪肝的治疗靶点,降低了直接抑制ASK1酶活性产生的毒副作用;第二篇文章证实了ALOX12-12-HETE依赖G蛋白偶联受体31显著促进缺血再灌注导致的肝脏损伤效应,并建立了世界首例非人灵长类动物恒河猴肝脏缺血再灌注模型,系统并长期监测了ML355在肝脏缺血再灌注过程中及后期对肝脏的保护作用。
TNFAIP3的关键作用
特异性针对ASK1的抑制剂selonsertib(GS-4997)已经成功进入非酒精性脂肪肝炎的III期临床试验,是最有希望的非酒精性脂肪肝病候选药物。然而,GS-4997几乎完全抑制ASK1的活性,可能破坏ASK1正常生理功能,从而造成毒副作用。
今年上半年,李红良教授研究组同样在Nature Medicine上发文,首次揭示了天然免疫重要分子CFLAR在非酒精性脂肪肝炎进程中的关键负调控作用,并深入阐明了其分子机制。CFLAR就是ASK1重要调节因子和非酒精性脂肪肝治疗潜在靶点之一。
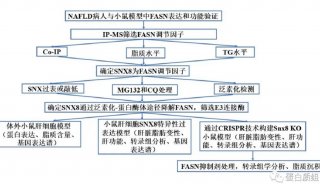
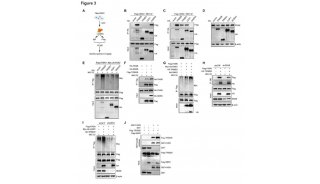
最新这篇文章围绕TNFAIP3,进一步通过高通量筛选和大量分子生物学实验,证实TNFAIP3非酒精性脂肪肝发生发展过程中关键的ASK1负调控分子。
研究人员发现TNFAIP3能够通过在病理条件下对ASK1进行去泛素化来抑制ASK1以及下游P38/JNK的活性,从而有效防止非酒精性脂肪肝及其并发症的发生发展。该研究以非酒精性脂肪肝的临床治疗药物研发为出发点,针对ASK1这个具有治疗前景的临床前药物靶点,寻找到了新的非酒精性脂肪肝的治疗靶点,降低了直接抑制ASK1酶活性产生的毒副作用,为非酒精性脂肪肝及相关代谢性疾病的临床治疗提供了新的理论基础。
肝脏缺血再灌注重要研究进展
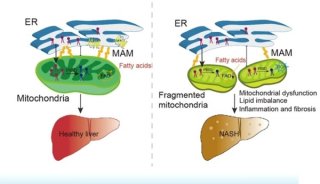
临床发现,肝脏缺血再灌注损伤可导致10%早期肝脏移植后器官衰竭,45%急慢性组织排异现象和器官损伤,极大限制了肝脏切除术的适应症及边缘性肝脏供体的应用,严重阻碍了肝脏手术的应用和救治效果。
为了找到肝脏缺血再灌注损伤的根本原因,李红良教授团队运用转录组学、蛋白组学和代谢组学联合分析,首次揭示了缺血阶段的脂质代谢紊乱是肝脏缺血再灌注损伤过程中的重要病变,其中,12-脂氧化酶(ALOX12)的上调和12羟基二十烷四烯酸(12-HETE)蓄积尤为显著,而炎症及细胞死亡均为脂质代谢紊乱的后续事件。研究证实,ALOX12-12-HETE依赖G蛋白偶联受体31显著促进缺血再灌注导致的肝脏损伤效应,而使用ALOX12小分子抑制剂ML355可有效缓解肝脏损伤。该研究同时建立了世界首例非人灵长类动物恒河猴肝脏缺血再灌注模型,系统并长期监测了ML355在肝脏缺血再灌注过程中及后期对肝脏的保护作用。
这项研究是肝脏缺血再灌注领域的重大理论创新,提出肝脏缺血再灌注损伤的根本原因是缺血阶段脂质信号网络重构,使国际上研究者重新认识该疾病的根本发病机制,此项研究革新了肝脏缺血再灌注损伤的根本发病机制,填补了临床治疗肝切除及肝移植过程中缺血再灌注损伤的空白。该研究已申请药物开发和临床应用ZL4项,目前正进一步与药物开发公司合作开发相关疾病的临床药物。
-
科技前沿
-
科技前沿

-
项目成果
-
项目成果