科研 | 武汉大学:非酒精性脂肪性肝的治疗新靶点
导读
非酒精性脂肪性肝(NAFLD)是最常见的慢性肝病,临床上没有任何FDA批准的药物干预方法。脂肪酸合成酶(FASN)是NAFLD治疗中最具吸引力的目标之一,可调控肝脏脂肪从头合成(DNL)。然而,FASN在NAFLD中的调控机制和针对FASN的潜在治疗策略在很大程度上仍然未知。通过对FASN复合物的系统相互作用组学分析,我们筛选并鉴定了分选连接蛋白8(SNX8)作为FASN的新结合伙伴。SNX8直接与FASN结合并促进FASN泛素化及蛋白酶体降解。我们进一步证明了SNX8通过招募E3连接酶TRIM28,并增强TRIM28-FASN相互作用来介导FASN蛋白降解。值得注意的是,Snx8对肝细胞的干扰使得体外脂质积累,而SNX8过表达阻止了肝细胞脂质沉积。此外,我们在体内验证了Snx8 缺失对NAFLD的加重作用,与野生型对照相比,Snx8基因敲除小鼠的肝脏脂肪变性显著加剧,脂肪合成途径处于活跃状态。肝细胞Snx8特异性过表达显著抑制了HFHC诱导的肝脏脂肪变性。值得注意的是,SNX8对NAFLD的保护作用很大程度上取决于对FASN的抑制。这些数据表明SNX8是NAFLD的关键抑制因子,可促进FASN蛋白降解。针对SNX8-FASN是一种有前途的预防和治疗NAFLD的新策略。
论文ID
原名:FASN-suppressor screening identifies SNX8 as a novel therapeutic target for NAFLD
译名:FASN抑制因子筛选确定SNX8作为NAFLD的新治疗靶点
期刊:Hepatology
IF:17.425
发表时间:2020.07.07
通讯作者:李红良
通讯作者单位:武汉大学生命科学学院
实验设计
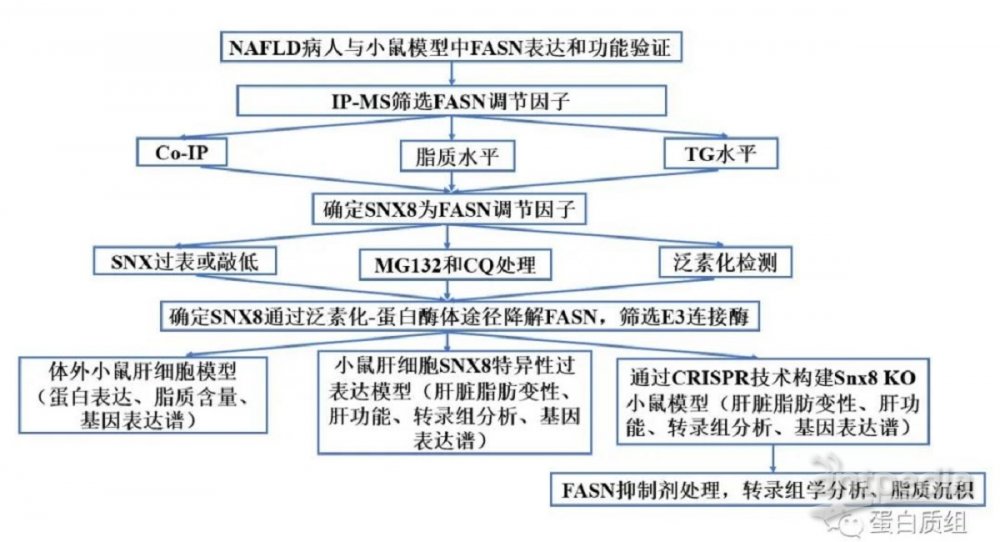
实验结果
1.SNX8被鉴定为NAFLD中FASN的直接调节因子
由于FASN可能在脂肪肝的不同阶段中发挥不同甚至相反的功能,我们首先通过检查研究模型中的FASN蛋白表达和功能来验证FASN在NAFLD中承担的角色。与之前的研究报道一致,我们发现,与相应的对照相比,NAFLD小鼠、喂食HFHC饮食的小鼠以及经PAOA处理的人类肝细胞中FASN表达水平显着升高(图1A-C)。值得注意的是,PAOA处理的肝细胞中FASN过表达导致细胞中脂质积累,细胞TG水平显著升高(图1D-E)。为了系统地识别FASN的关键调节因子,我们构建Flag标记的FASN过表达肝细胞,并使用抗Flag 抗体进行IP,此方法与质谱联用(IP-MS)。我们通过对肽谱分数进行排序,筛选出9个潜在调节因子(图1F)。我们采用了进一步的IP检测以验证这些候选因子与FASN的相互作用,结果显示BAG2、PSMD2、CASP14、PSMB6 和SNX8与FASN具有强相互作用(图1G)。重要的是,SNX8过表达表现出最显著的降低FASN蛋白水平的能力(图1H)。尼罗红染色结果显示SNX8过表达,相比比其它蛋白质过表达,对肝细胞脂质含量的影响更大,这些发现通过细胞TG水平测定得到验证(图1I-J)。这些数据表明SNX8是FASN介导的NAFLD进展的潜在抑制剂。
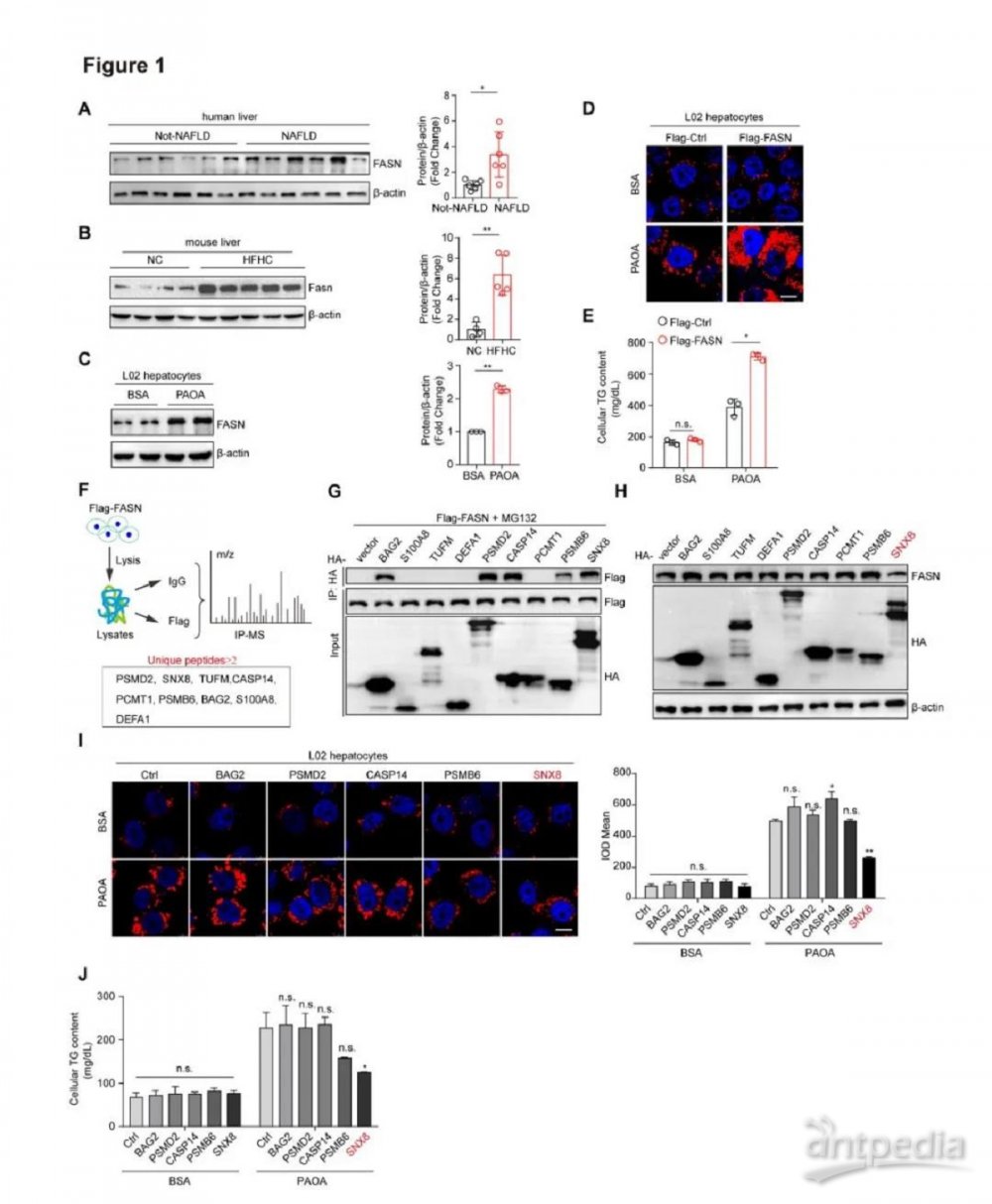
图1.SNX8作为NAFLD中FASN的直接调节因子
A,来自NAFLD患者和非NAFLD人群对照的肝脏样品中FASN蛋白表达(蛋白质印迹分析)。蛋白质水平在右侧定量,每组n=6。B,喂食NC饮食或HFHC饮食16周的小鼠肝脏中Fasn蛋白表达(蛋白质印迹分析)。n=4-5。C,经BSA或PAOA中处理的人L02肝细胞中FASN蛋白水平的蛋白质印迹分析。实验重复3次,右侧为蛋白质水平定量。D,PAOA处理下FASN过表达细胞中尼罗红染色的代表性图像。比例尺,10微米。E,PAOA(0.5 mM棕榈酸(PA)和1 mM油酸(OA)) 处理下FASN过表达细胞中TG的含量。n=3。F,用于识别FASN过表达L02细胞中FASN潜在结合蛋白的IP-MS实验程序流程图。右侧列出了指示的潜在候选蛋白质(独特肽≥2)。G,293T细胞中FASN与来自IP-MS分析的潜在候选蛋白之的Co-IP分析。H,用指定质粒转染的细胞中FASN蛋白水平(免疫印迹分析)。I,L02细胞尼罗红染色成像,这些细胞中指定的蛋白质稳定过表达并经PAOA处理。通过量化每个细胞中的阳性信号强度来分析数据。n=3。比例尺,10微米。J,在PAOA处理下稳定过表达指定蛋白质的L02细胞中甘油三酯(TG)的含量。
2.SNX8通过泛素化-蛋白酶体途径降解FASN
我们通过内源性IP检测和GST pulldown检测进一步证实了SNX8和FASN之间的直接相互作用(图2A-B)。此外,PAOA处理后SNX8-FASN相互作用增强(图2C-D)。我们发现FASN蛋白表达水平因SNX8过表达而降低,因SNX8敲低而增加,而当SNX8过表达或耗尽时,FASN mRNA水平保持不变(图2E-F)。鉴于SNX8在核内体分选中的作用,我们用溶酶体降解抑制剂氯喹或蛋白酶体降解抑制剂MG132处理SNX8过表达的293T细胞,并检测FASN表达。有趣的是,MG132处理比氯喹更有效地逆转了SNX8介导的FASN降解(图2G),这表明SNX8介导的FASN降解依赖于蛋白酶体途径。同时,SNX8促进了FASN的泛素化(图2H),此泛素化类型为K48连接的泛素化(图2I-J)。然而,在体外试验中,在缺乏E3的情况下,SNX8失去了促进FASN泛素化的能力,这表明SNX8介导的FASN泛素化和降解是由E3连接酶介导的(图2K)。
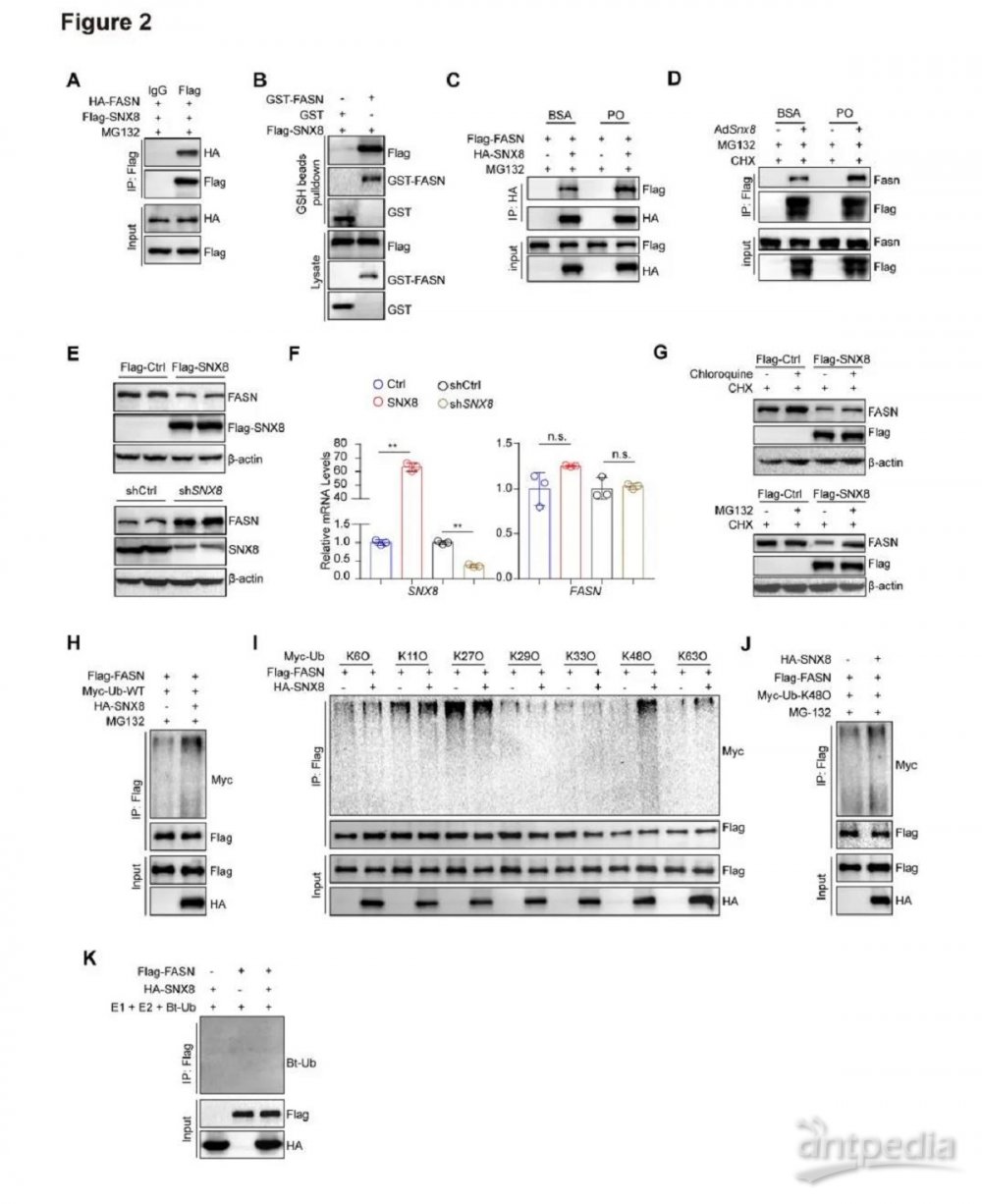
图2.SNX8通过泛素化-蛋白酶体途径降解FASN
A,L02细胞中FASN和SNX8之间相互作用的Co-IP分析。B,FASN和SNX8的直接相互作用,通过GST pull-down和免疫印迹进行分析。C,PAOA和BSA给药下L02细胞中FASN和SNX8相互作用的Co-IP分析。D,PAOA和BSA给药下小鼠原代肝细胞中FASN和SNX8相互作用的Co-IP分析。E,过表达或敲低SNX8的L02细胞中FASN和SNX8蛋白质水平(蛋白质印迹分析)。F,过表达或敲低SNX8的L02细胞中FASN和 SNX8的相对mRNA水平。G,在氯喹 (CQ) 或MG132存在下,用SNX8过表达质粒和相应对照转染的293T细胞中FASN的蛋白质水平。H,存在或不存在SNX8时FASN的泛素化水平。I,用Ub和SNX8质粒的指定突变体转染的293T细胞中FASN泛素化IP分析。J,与指定质粒共转染的293T细胞中FASN的K48连接泛素化的IP分析。K,在SNX8存在下FASN的体外泛素化测定。
3.SNX8通过招募TRIM28增强FASN泛素化
为了探索SNX8和FASN泛素化之间的直接联系,我们在SNX8过表达细胞中进行了相互作用组学分析,并确定了两种潜在的E3连接酶,TRIM28和WDR43(图3A)。之前的研究表明TRIM21和COP1也可能参与FASN泛素化和降解。下一步,我们在TRIM28、TRIM21、COP1和 WDR43这4个E3连接酶中,筛选负责SNX8介导的FASN降解的潜在候选者。值得注意的是,只有TRIM28与SNX8和FASN具有相互作用(图3B-C)。更重要的是,TRIM28对FASN蛋白降解和K48型泛素化具有显著促进作用(图3D-E)。由于SNX8和TRIM家族蛋白都位于逆运复合体中,我们假设SNX8通过招募TRIM28并形成调节复合物来增强FASN泛素化。如图3F-G所示,SNX8过表达显著增强了Trim28和ASN之间的相互作用,以及TRIM28诱导的FASN K48泛素化。相反,当SNX8被敲低时,TRIM28-FASN相互作用和TRIM28介导的FASN泛素化水平发生显著降低(图3H-I)。我们进一步进行了GST pull-down分析并得出结论,SNX8作为一个支架蛋白促进FASN-TRIM28相互作用(图3J)。这些数据表明,SNX8将TRIM28募集到FASN处并增强TRIM28介导的FASN泛素化和降解。
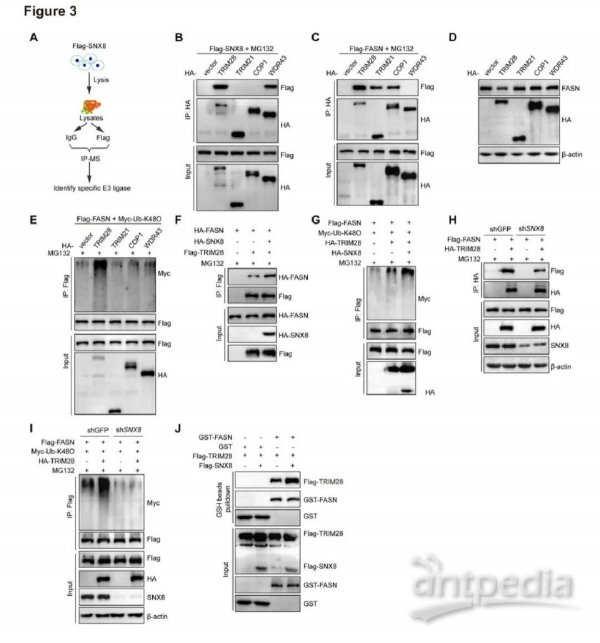
图3.SNX8通过增强FASN和TRIM28的相互作用来增强FASN泛素化
A,示意图显示了IP-MS策略,用于识别介导SNX8诱导的FASN降解的潜在E3连接酶。B,SNX8和TRIM28、TRIM21、COP1、WDR43在293T细胞中相互作用的IP分析。C,FASN与TRIM28、TRIM21、COP1、WDR43在293T细胞中相互作用的IP分析。D,TRIM28、TRIM21、COP1、WDR43转染的293T细胞中FASN蛋白质水平(蛋白质印迹分析)。E,与TRIM28、TRIM21、COP1、WDR43共转染的293T细胞中FASN的K48连接泛素化的IP分析。F,在SNX8存在和不存在情况下TRIM28和FASN相互作用的IP分析。G,用指定质粒转染的293T细胞中FASN的K48连接泛素化的IP分析。H,在SNX8敲低细胞(shSNX8)或对照细胞(shCtrl)中通过IP检测Trim28和FASN的相互作用。I,在SNX8敲低细胞(shSNX8)或对照细胞(shCtrl)中检测到TRIM28对FASN的 K48连接泛素化的IP分析。J,GST pull-down分析表明SNX8促进了FASN和TRIM28的直接相互作用。GST-HA 作为对照。
4.SNX8增强FASN泛素化不依赖于K12乙酰化
先前的一项研究表明FASN乙酰化促进肝细胞癌中的FASN泛素化和降解。有趣的是,通过IP-MS鉴定在与SNX8的具有相互作用的蛋白中也包含乙酰化(K12)FASN(图4A)。因此,我们想知道SNX8介导的FASN泛素化和降解是否依赖FASN乙酰化。与IP-MS数据一致,SNX8触发了FASN的乙酰化,当FASN的K12乙酰化位点发生突变(K12D)时,SNX的调节作用被完全消除(图4B-C)。然而,SNX8促进了FASN(WT)和FASN (K12D)突变蛋白的蛋白酶体降解(图4D),这表明SNX8介导的FASN泛素化与K12乙酰化无关。更重要的是,co-IP分析表明,FASN K12乙酰化对于FASN与SNX8或TRIM28的相互作用(图4E-F)以及SNX8 /TRIM28调节的FASN泛素化(图4G-H)并不是必需的。SNX8促进了TRIM28与FASN WT及K12D突变体的相互作用(图4I)。总之,这些数据表明TRIM28介导的FASN 泛素化与其乙酰化调节无关。
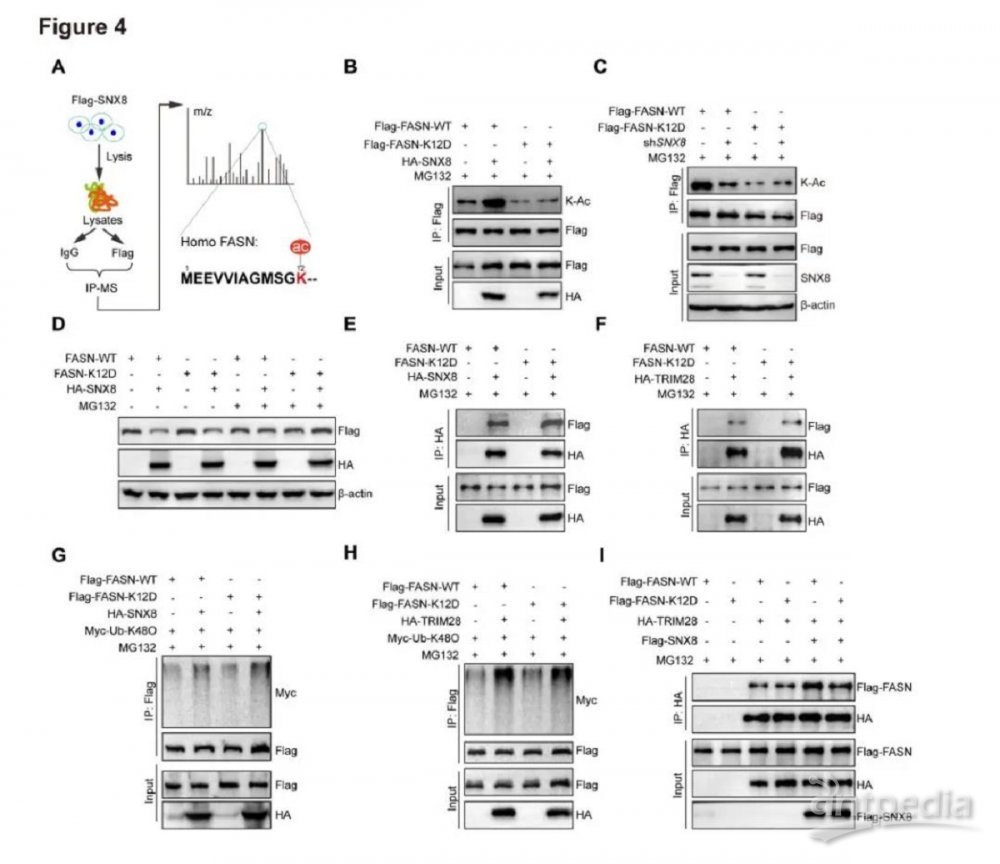
图4.SNX8增强FASN泛素化且与乙酰化无关
A,通过IP-MS在SNX8过表达的L02细胞中鉴定FASN的乙酰化赖氨酸残基。B,在SNX8过表达、FASN WT或K12D突变质粒转染的293T细胞中检测到FASN乙酰化水平增加。C,在用FASNWT或K12D突变质粒转染的SNX8 shRNA细胞 (shSNX8) 或对照细胞 (shCtrl)中检测到FASN乙酰化水平降低。D,用指定质粒转染的293T细胞中FASN蛋白质水平(蛋白质印迹分析),MG132处理。E,SNX8与FASN的WT或K12D突变体之间的相互作用,通过IP测定进行分析。F,通过IP检测分析TRIM28与FASN的WT或 K12D突变体之间的相互作用。G,与或不与SNX8共转染时,通过IP测定分析FASN的WT或K12D突变体 K48连接的泛素化水平。H,与或不与TRIM28共转染时,通过IP测定分析FASN的WT或K12D突变体的K48连接的泛素化水平。I,在SNX8存在和不存在的情况下,TRIM28与FASN的WT或K12D突变体之间相互作用的IP分析。
5.SNX8在体外抑制肝脏脂质积累
鉴于SNX8对FASN降解的有效促进作用,我们接下来探讨了SNX8在肝细胞脂质代谢中的作用。小鼠肝细胞中的SNX8基因敲除显着增加了PAOA诱导下的脂质积累(图5A-B),而在PAOA压力下SNX8过表达显著抑制了细胞脂质含量(图5C-D)。我们进一步证实了SNX8对PAOA处理下的人肝细胞细胞系模型中脂质积累的抑制作用(图5E-H)。值得注意的是,在BSA处理下,SNX8对基线脂质含量和细胞特征的影响可以忽略不计(图5A-H)。我们接下来探讨了SNX8对涉及DNL的基因表达谱的影响(图5I)。基因表达分析结果表明,在SNX8过表达的肝细胞中,参与脂肪酸延伸的FASN下游基因被显著抑制,而ACACA和FASN基因则保持不变(图5J)。SNX8敲低显著增加了一些基因的表达,包括HADC2、ELOVL5、ELOVL6、ELOVL7和SCD1(图5K)。
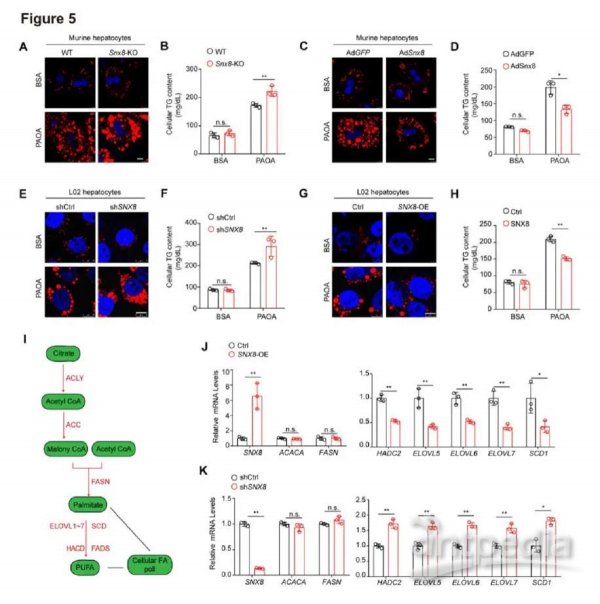
图5.SNX8在体外抑制肝脏脂质积累
A,来自Snx8-KO或WT小鼠的肝细胞中尼罗红染色的代表性图像。细胞用PAOA(0.5mMPA和1mM OA)或BSA处理1小时,然后用尼罗红染色。比例尺10微米。B,用PAOA(0.5mMPA和1mMOA)或BSA处理12小时的Snx8-KO或WT鼠原代肝细胞中的TG含量。C-D,感染表达Snx8(Ad-Snx8)或对照GFP(Ad-GFP)的腺病毒的鼠肝细胞中尼罗红染色和细胞TG含量的代表性图像。细胞用PAOA(0.5 mM PA和1 mMOA)或BSA处理12 小时,然后进行尼罗红染色。比例尺,10微米。E, G,用PAOA(0.5 mM PA和1 mM OA)或BSA处理12小时的SNX8过表达或敲低细胞中尼罗红染色的代表性图像。比例尺,10微米。F, H,用PAOA(0.5 mM PA和1 mM OA)或BSA刺激12小时的SNX8过表达或敲低细胞中的TG含量。I,脂肪从头合成途径示意图。J,SNX8过表达L02细胞及对照细胞中SNX8和参与脂肪从头合成的酶的相对mRNA水平。K,SNX8敲低L02细胞和对照细胞中SNX8和参与脂肪从头合成的酶的相对mRNA水平。
6.肝细胞特异性Snx8过表达可防止小鼠NAFLD进展
由于Fasn介导的脂肪酸合成和脂质沉积主要位于肝细胞,我们通过睡美人转座子(sleeping beauty transposon)系统生成肝细胞特异性Snx8过表达小鼠,以验证肝细胞Snx8在NAFLD进展中的作用。我们通过蛋白质印迹证实了Snx8-HTG小鼠中Snx8的成功过表达(图6A)。与Snx8-NTG对照相比,Snx8过表达增强了Fasn泛素化,肝脏中的Fasn蛋白水平显著降低(图6B)。此外,Snx8-HTG小鼠的肝脏重量以及肝脏重量与体重之比显著低于NTG组,而Snx8过表达在HFHC治疗后16周对体重和葡萄糖耐受不良的影响可以忽略不计(图6C-D)。值得注意的是,与HFHC饮食下的Snx8-NTG组相比,Snx8-HTG小鼠的肝脏脂肪变性和肝功能障碍获得了有效改善(图6E-G),而在NC饮食条件下Snx8-HTG小鼠和Snx8-NTG小鼠之间,肝脏脂肪变性和肝脏重量没有显著差异(图6E&G)。与表型观察一致,Snx8显著降低了与脂肪酸合成和炎症反应相关的基因的mRNA表达(图6H)。转录组学分析证明,Snx8肝细胞特异性过表达降低了与脂肪酸延伸及不饱和脂肪酸生物合成过程相关的基因表达(图6I-K)。
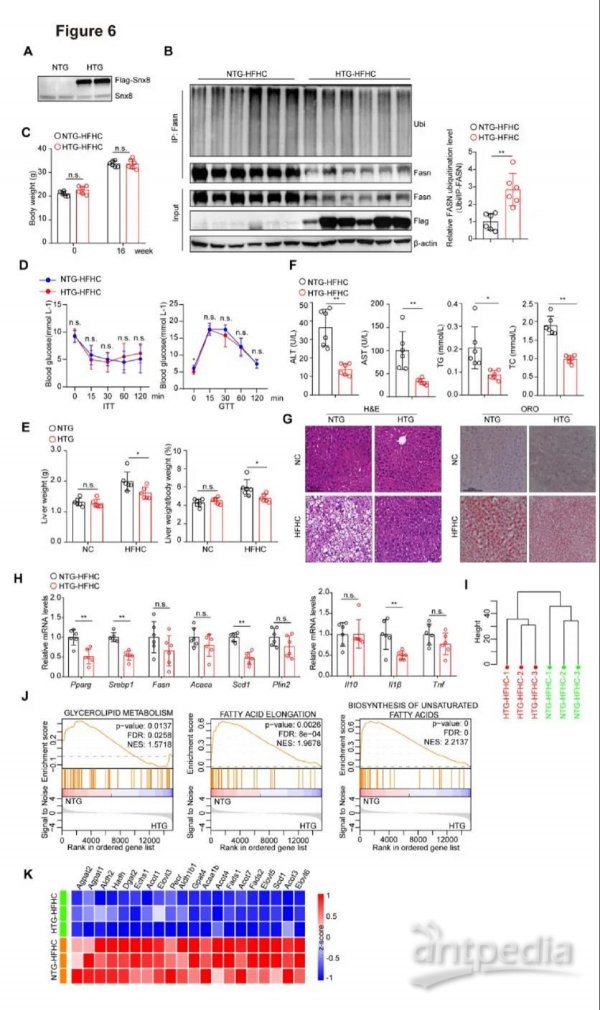
图6. 肝脏Snx8特异性过表达小鼠抵抗饮食诱导的肝脂肪变性
A,Snx8-HTG小鼠和Snx8-NTG小鼠(n = 2)中Snx8过表达验证(蛋白质印迹分析)。B,在用HFHC饮食喂养16周的Snx8-HTG小鼠和Snx8-NTG小鼠(n = 6)中分析Fasn的泛素化水平。C,HFHC饮食喂养16周期间Snx8-HTG小鼠和Snx8-NTG小鼠(n=6)的体重增加。D,用HFHC饮食喂养16周的Snx8-HTG小鼠和Snx8-NTG小鼠的GTT、ITT测试(n= 6-7)。E,用HFHC饮食喂养16周的Snx8-HTG小鼠和Snx8-NTG小鼠的肝脏重量、肝脏与体重之比(n = 6)。F,喂食HFHC饮食的Snx8-HTG小鼠和的Snx8-NTG小鼠的血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆固醇(TC)、甘油三酯(TG)水平(n =6)。G,用HFHC和NC饮食喂养16周Snx8-HTG小鼠和Snx8-NTG小鼠肝脏切片中H&E染色和油红染色的代表性图像(n = 6)。比例尺,100μm。HSnx8-HTG小鼠和Snx8-NTG小鼠(n = 6)中参与脂质合成和炎症的基因的相对mRNA水平。I,聚类图像,根据RNAseq中的基因表达模式显示了来自HFHC诱导的Snx8-NTG和Snx8-HTG小鼠的样本分布。n= 3。J,GSEA显示了基于喂食HFHC饮食的Snx8-NT小鼠和Snx8-HTG小鼠中RNA-seq数据的脂质代谢相关途径。n = 3。K,热图,显示基于喂食HFHC饮食的Snx8-NTG小鼠和的Snx8-HTG小鼠的RNA-seq数据集的脂质代谢相关基因的表达谱。n = 3。
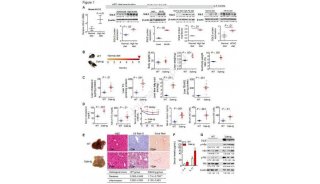
7.Snx8耗竭加重饮食诱导的肝脂肪变性
为了进一步研究Snx8在体内NAFLD进展中的作用,我们通过CRISPR-Cas9系统生成了Snx8-KO小鼠(图7A)并在16周HFHC饮食诱导NAFLD模型中评估Snx8的作用。因为Snx8-NTG和Snx8-HTG组没有发展到脂肪变性阶段并且在NC饮食下观察到两组没有显著差异,我们放弃NC饮食作为HFHC饮食的对照组。蛋白质印迹分析证明了Snx8-KO小鼠中Snx8蛋白的成功敲除(图7B)。值得注意的是,与来自Snx8-WT小鼠相比,来自Snx8-KO小鼠肝脏中的Fasn泛素化水平显著降低,而Fasn蛋白水平显著增加(图7C)。我们发现,与WT小鼠相比,Snx8缺失的小鼠具有更高的肝脏重量和更高的肝脏重量/体重比(图7D)。Snx8敲除还显著加剧了饮食诱导的肝脏脂肪变性和肝部脂质增加(图7E-F)。Snx8-KO小鼠血清中天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)水平升高,表明它发生了比 对照组更严重的肝损伤(图7G)。转录组学分析证明,Snx8敲除显著上调脂肪酸合成和脂肪酸延伸途径(图7H-J)。与过表达结果一致,这些数据有力地证明了Snx8缺乏会在代谢压力下加剧肝脏脂肪变性。
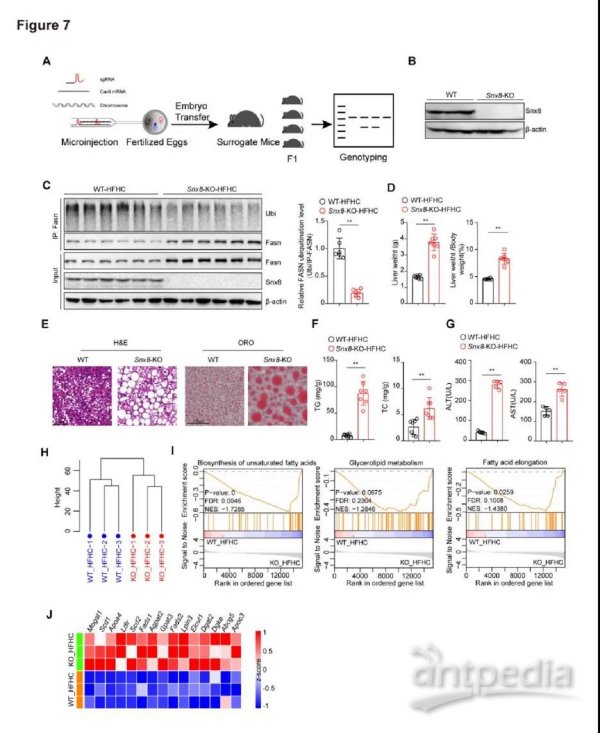
图7.Snx8基因敲除加重HFHC诱导的肝脏脂肪变性
A,Snx8-KO小鼠构建示意图。通过PCR测定鉴定小鼠基因型。B,Snx8-KO小鼠和WT小鼠(n = 3)中Snx8 KO效率(蛋白质印迹分析)。C,在喂食16周HFHC饮食的Snx8-KO小鼠和的WT小鼠(n =6)中分析Fasn的泛素化水平。D,用HFHC饮食喂养16周Snx8-KO小鼠和的WT小鼠的肝脏重量、肝脏与体重之比(n = 7)。E,用HFHC饮食喂养16周Snx8-KO小鼠和WT小鼠的肝脏切片中的H&E染色和油红染色的代表性图像(n = 4)。比例尺,100μm。F,在喂食HFHC饮食16周的Snx8-KO小鼠和WT小鼠(n = 7)中量化肝脏甘油三酯(TG)的含量。G,喂食HFHC饮食的Snx8-KO小鼠和的WT小鼠(n = 5)的血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平。H,聚类图像,显示HFHC诱导的WT和Snx8-KO小鼠样本基于RNA-seq分析的基因表达模式分布。I,GSEA显示了基于喂食HFHC饮食的Snx8-KO小鼠和WT小鼠RNA-seq数据集的与脂质代谢相关的丰富途径。J,热图,显示基于喂食HFHC饮食的Snx8-KO小鼠和WT小鼠的RNA-seq数据集的脂质代谢相关基因的表达谱。n = 3。
8.FASN 活性对于脂质代谢中的 SNX8 功能是必需的
我们通过评估FASN被抑制的Snx8-KO肝细胞中的脂质积累来探索SNX8在NAFLD中的功能是否依赖于FASN。用腺病毒对Fasn进行抑制,Fasn抑制显著消除了Snx8KO细胞因PAOA诱导而发生脂质积累加剧(图8A-B)。此外,用C75(一种FASN抑制剂)对FASN 进行药理学抑制,这在很大程度上消除了SNX8消耗对原代肝细胞(图8C-D)和人L02细胞(图8E-F)中脂质沉积的加重作用。一致的是,SNX8敲低的细胞中基因表达的上调被FASN抑制作用抵消(图8G)。我们还通过系统RNA测序(RNA-seq)验证了上述结果(图8H)。如图8I所示,在SNX8基因敲低组中,与脂质代谢相关的信号通路明显富集。然而,shSNX8组的通路上调被C75处理作用逆转。热图分析结果进一步支持了以下发现,即 shSNX8组中与脂质代谢相关的基因表达可被FASN抑制逆转(图8J)。这些数据清楚地表明,SNX8对NAFLD的保护作用很大程度上取决于它对FASN的抑制。
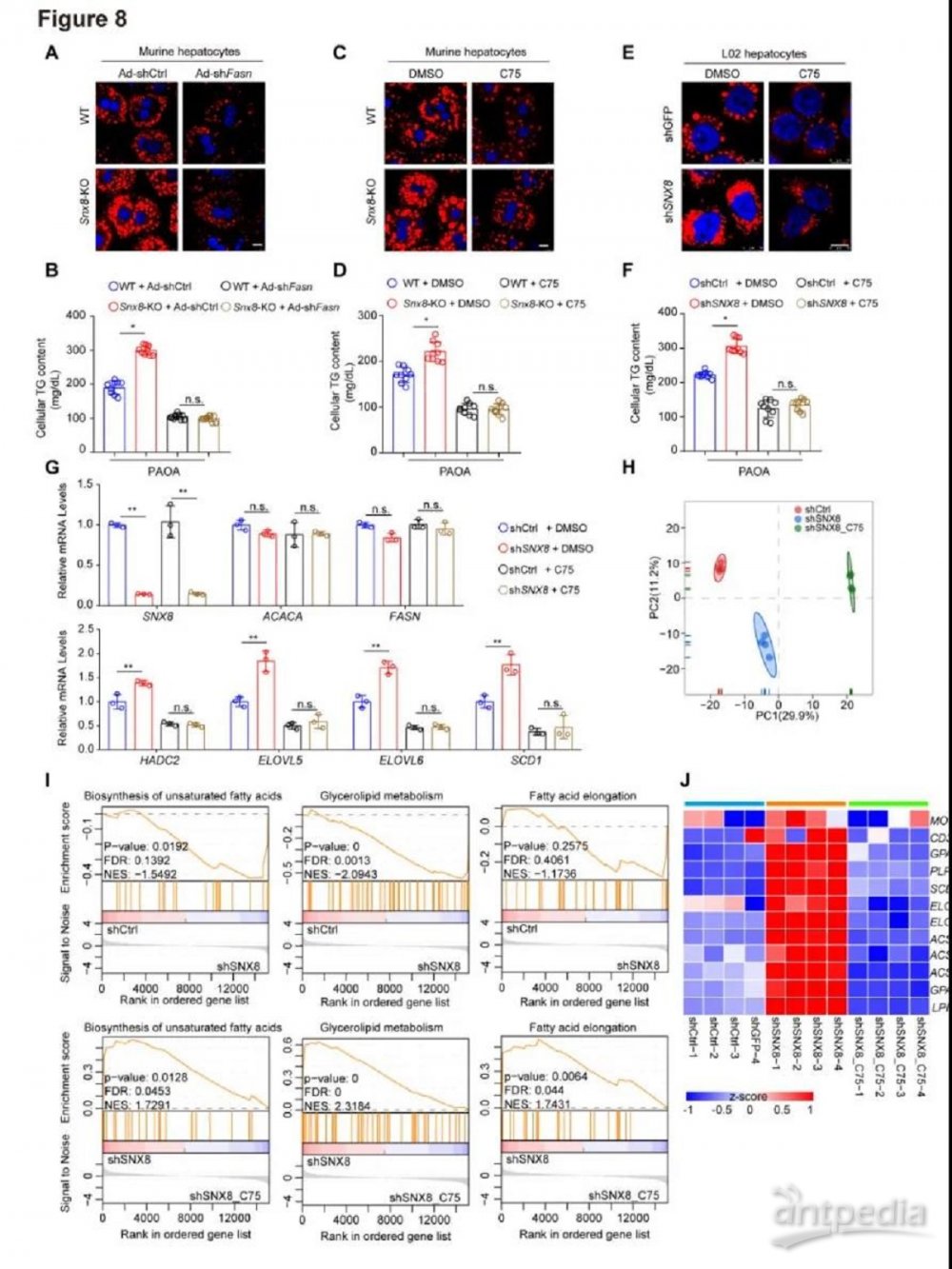
图8.FASN在脂质代谢中是SNX所必需的
A-B,在PAOA(0.5 mM PA和1 mM OA) 处理的刺激下,被Fasn shRNA腺病毒感染的Snx8-KO或WT小鼠肝细胞中尼罗红染色(A)和细胞TG含量(B)的代表性图像。比例尺,10微米。C-D,用FASN抑制剂C75(25μM)或DMSO处理24小时,Snx8-KO或WT鼠肝细胞中尼罗红染色(C)和细胞TG含量(D)的代表性图像。E-F,用C75处理的SNX基因敲低细胞(shSNX8)或相应对照细胞(shCtrl)中尼罗红染色(E)和细TG含量(F)的代表性图像。比例尺,10微米。G,用C75处理的shSNX8和shCtrl细胞中脂质代谢基因(FASN、ACACA、HADC2、ELOVL5、SCD1)的相对mRNA水平。H,主成分分析(PCA),显示了指定样品的分布。I,GSEA,用FASN抑制剂C75(25μM)或DMSO处理24小时的SNX8基因敲低细胞(shSNX8)或相应对照细胞(shCtrl)RNA测序分析,分析指定组中与脂质代谢和炎症相关的富集途径。J,热图,显示指定组中与脂质代谢、炎症相关的基因的表达谱。
讨论
肝细胞中过多的脂质积累导致脂毒性,这是NAFLD的主要标志。在本研究中,我们提供了第一个证据,证明SNX8通过靶向FASN进行降解,因而SNX8可能成为NAFLD的新型抑制剂。我们证明了SNX8直接与FASN结合,并通过招募TRIM28和增强TRIM28介导的FASN K48型泛素化来促进其降解。当通过基因敲低或使用特定抑制剂抑制FASN时,SNX8消耗对脂质积累和脂肪酸代谢紊乱的加剧影响几乎完全消除。这项研究强烈表明SNX8-FASN是NAFLD的新治疗靶点。
众所周知,NAFLD或肥胖患者的肝脏FASN表达水平显著升高。FASN在与脂质代谢失调相关的癌细胞中也高度表达,例如乳腺癌、结直肠癌和肝细胞癌。FASN是一种核心调节剂,可促进肝脏DNL,并催化丙二酰辅酶A和乙酰辅酶A转化为棕榈酸酯,经延伸、去饱和以及酯化,最终造成肝脏中甘油三酯的积累。FASN的脂肪合成能力使其有希望成为治疗代谢疾病的靶点。先前的临床试验表明,FASN抑制剂可以减少肥胖患者和NAFLD患者的肝脏DNL和脂肪变性。然而,FASN KO小鼠在喂食零脂肪饮食或禁食时会发生脂质积累,因而直接靶向FASN可能会引发慢性靶向安全风险。因此,我们需要揭示FASN的详细调控机制,以进一步探索在病理条件下特异性调控FASN的有前景的治疗靶点。
FAS表达在转录和转录后水平上均受到调节。几种转录因子已被发现可控制FASN表达,例如甾醇调节元件结合蛋白1(SREBP-1)、碳水化合物受体元件结合蛋白(ChREBP)和肝脏X受体(LXR)。NAFLD患者的最新研究表明,ChREBPβ激活脂肪合成基因转录是DNL的主要原因之一。然而,转录因子难以直接靶向,翻译后调节因子是更有前景且可成药的靶标。先前的研究表明,FASN的稳定性受泛素化-蛋白酶体途径的调节。E3连接酶COP1可以招募FASN和Shp2形成复合物,诱导FASN降解,而去泛素化酶USP14和USP2a直接与FASN结合并增加其稳定性以促进脂质积累和肝脂肪变性。在我们的研究中,我们发现SNX8是一种新型的FASN抑制因子,它直接与FASN结合并通过募集E3连接酶促进蛋白质降解。SNX8属于保守的SNX家族,其成员在细胞内运输中起着关键作用,包括早期内体到反式高尔基体网络运输、内吞作用和蛋白质回收等。SNX家族成员还可以作为泛素化调节系统和免疫系统中的适配器。我们的研究首次通过一种新的分子机制阐明了SNX8在代谢功能障碍中起着至关重要的作用,即SNX8作为一种支架蛋白,将E3连接酶募集到FASN以进行泛素化介导的降解。
我们发现SNX8在PAOA治疗后特异性减弱肝细胞脂质积累,这可能是由于 SNX8-FASN相互作用的特定模式或生理与病理条件下的相互作用。在SNX8表达没有显著变化的情况下,SNX8-FASN相互作用增强以响应NAFLD前代谢刺激,这可能是FASN表达增加导致的负反馈,以抑制NAFLD进展过程中不受控制的FASN介导的脂肪生成。此外,考虑到FASN在从丙二酰辅酶A到棕榈酸酯的转化中的关键作用,SNX8的过表达将导致棕榈酸酯的产生减少,从而导致肝脏中丙二酰辅酶A的积累,有利于防止肝脂肪变性。
FASN的泛素化和降解被认为依赖于KAT8和HDAC3的乙酰化作用。然而,NAFLD进展中SNX8调节的FASN降解不依赖于FASN乙酰化。关于乙酰化参与FASN降解的不一致性可能是由病理生理阶段的差异引起的。虽然KAT8-HDAC3调节的FASN乙酰化调控癌细胞中的FASN降解,但我们的研究是在NAFLD模型中进行的。O-GlcNAclytion是另一种蛋白质修饰,可以调节FASN与其它E3连接酶或去泛素化酶的相互作用,导致代谢紊乱。FASN的O-GlcNAclytion修饰在这个过程中的作用值得进一步研究。
总之,我们的研究结果揭示了在 NAFLD进展过程中SNX8通过翻译后水平调节FASN稳定性的调节机制。SNX8通过募集TRIM28进行K48连接的泛素化,进而诱导随后的FASN蛋白酶体降解,是肝脏脂肪变性的关键抑制因子。这些发现为NAFLD发病机制中的FASN表达提供了一个新的调控方式。靶向SNX8-FASN将是一种有前途的NAFLD药理学治疗策略。
-
仪器推荐
-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 3981
询底价 Tel:400-6699-117 转 3981 -
仪器推荐

-
仪器推荐

-
科技前沿
-
项目成果
-
项目成果