肝损伤动物模型介绍
这真是一个可怕的事实:同为黄种人,生长在中国的肝病发病率却是生活在欧美的3倍!中国无疑成为了“肝病大国”,约12个人就有1人患肝病。面对如此严峻的现状,对肝相关疾病机制研究和药物开发就变得极为迫切。
肝脏是人体重要的器官,执行合成代谢、解毒和免疫防御等许多功能。外界环境各类因素常导致肝损伤,长期的肝损伤将诱发如肝炎、肝硬化和肝癌等疾病,最终会导致肝衰竭(如下图)。
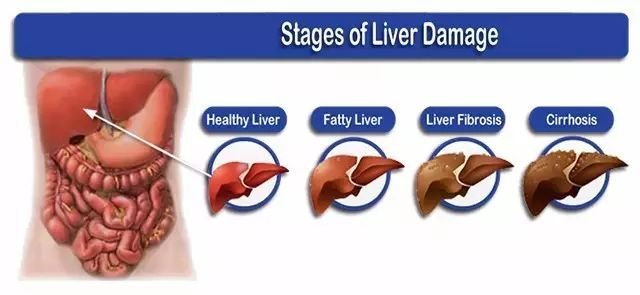
图1. 肝损伤不同阶段
目前,针对各种肝损伤疾病仍然是无药可治,肝细胞移植成为治疗终末期肝损伤最有效的方法之一,然而却面临着供体肝细胞来源匮乏、细胞活力不足及免疫排斥等诸多挑战。因此,科研工作者在研究肝疾病的过程中,选择准确的肝疾病动物模型对推动肝病治疗至关重要。
肝损伤相关动物模型
外源性诱导:主要是指化学性肝损伤动物模型是通过化学性肝毒物质,如四氯化碳(CCL4)、丙烯醇、D一氨基半乳糖、呋喃等化学物质致肝损伤。
举例:CCL4可以诱发急性和慢性肝损伤,CCL4在肝脏细胞微粒体内的细胞色素P450的作用下,产生自由基及一系列氧活性物,使细胞膜、内质网膜等发生氯烷基化和脂质过氧化,损伤膜的结构和功能,最终导致肝细胞死亡。但是损伤程度无法达到肝脏再殖程度,很难模拟外界细胞植入过程。
缺陷:外源性的再生刺激对宿主细胞同样有增殖作用,不能产生持续的肝损伤。
内源性肝损伤模型:主要是指基因突变的肝损伤模型,即动物体内可以持续发生肝损伤过程。这里应用的最广泛的主要是指:Fah-/-基因敲除动物模型。
Fah-/-基因敲除动物模型
Fah基因编码延胡索酰乙酰乙酸水解酶 (Fumarylacetoacetatehydrolase,Fah),正常情况下,酪氨酸最终代谢为延胡索酰和乙酰乙酸。酪氨酸代谢机制(下图 2)
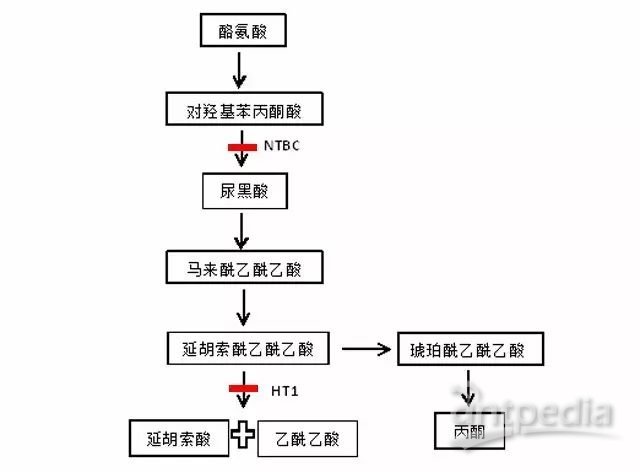
图2.酪氨酸代谢途径及致病机制
模型特征:Fah-/-基因敲除后,具备I型酪氨酸血症(Hereditary tyrosinemia type1,HT1)典型特征。Ⅰ型酪氨酸血症是一种因代谢酪氨酸最后一步反应所需的延胡索酰乙酰乙酸水解酶的缺失或功能缺乏而导致的常染色体隐性遗传疾病。该酶是由Fah基因编码,正常情况下,酪氨酸最终代谢为延胡索酰和乙酰乙酸;
当Fah基因发生缺失或突变,产生有毒的延胡索酰乙酰乙酸盐和马来酰乙酰乙酸,并产生其次级代谢产物丙酮,对肝、肾造成损伤。在早期阶段,肝脏损伤可造成肝死亡及肝硬化,肾脏损伤会引起佝偻病及发育障碍[1]。
应用范围:
1. Ⅰ型酪氨酸血症HT1的研究
该模型很好模拟了HT1产生的各种症状,是研究该病的理想模型。临床上NTBC虽可替代传统的肝移植治疗高酪氨酸血症,但是仍存在副作用,而且需要持续注射来维持疗效。到目前为止,还没有一种治疗方案能够根治HT1。因此,该模型对HT1致病机理和新型替代治疗方案的研究具有很高的临床价值[2]。
2. 肝相关疾病药物研发
由于Fah基因敲除在早期阶段,肝脏损伤可造成肝死亡及肝硬化,肾脏损伤会引起佝偻病及发育障碍,因此可为此类相关疾病提供药物筛选平台。
3. 肝细胞移植和再殖肝脏研究
Fah基因敲除可以产生持续不可逆的肝损伤,抑制肝细胞增殖,诱发自身肝细胞死亡,具有适合移植肝细胞的生活微环境,因此被认为是评价外源性肝细胞再殖损伤的理想动物模型。如Fah-/-IL2rg-/-缺陷小鼠,存在免疫缺陷(T细胞和NK细胞缺失),同样可进行外源干细胞移植,这为人胎来源的肝原始细胞的基础研究及临床应用奠定基础[3]。
但是,Fah基因敲除小鼠和猪虽然表型类似于人类的HT1,但是不能准确模拟人类肝损伤过程,特别是肝纤维化和肝硬化过程。大鼠在体积、亲缘性、遗传特性和疾病发展机理方面与人类更加接近,因此建立该大鼠模型具有重大临床价值[4]。
因为邦耀实验室本身在肝疾病动物模型方面也有所研究,所以下面分享一些相关模型。目前我们通过CRISPR-Cas9技术,获得了Fah基因缺失小鼠,构建Fah大鼠。该大鼠模型Fah基因缺失后,酪氨酸代谢受阻,毒性代谢产物蓄积,引起肝、肾的严重损伤。并且观察到小鼠和猪身上没有的肝纤维化和肝硬化。该模型的最新研究已发表在《Scientific Reports》上[5],感兴趣的童鞋可以了解一下。
目前邦耀实验室通过CRISPR-Cas9技术已成功构建Fah基因缺陷的大小鼠,如果您在实验中有相关问题和需要,可以随时与我们沟通联系!
Fah-/-基因敲除大鼠
简称:SD –Fah-/-
基因型:纯合子
模型构建:在Fah基因的第2号外显子上敲除10个碱基
模型特点:
具备I型酪氨酸血症(HT1)典型特征;
不仅观察到肝功能衰竭,还具有在敲除小鼠和猪模型中看不到的肝纤维化和肝硬化特征;
可以成功移植外源肝细胞,使大鼠重获肝脏正常功能。
研究应用:
Fah-/-大鼠存在广泛而持续的肝损伤,除了应用于Ⅰ型酪氨酸血症,还可以可用于细胞移植、肝脏持续损伤、肝再生、肝癌及肝脏疾病修复治疗的研究中。
1. 大鼠肝脏组织进行Anti-Fah免疫组化染色(Fah基因缺失的小鼠无Fah抗体的表达),表明模型构建成功。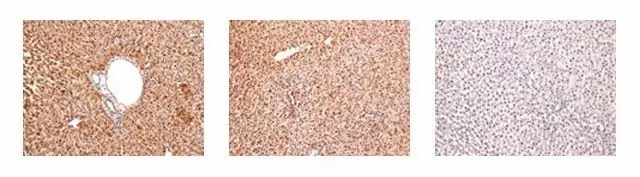
Rat liver(20×,WT),Rat liver(20×,HZ),Rat liver(20×,KO)
2. 不给予NTBC治疗后Fah-/-大鼠发生肝坏死和肝硬化[5]
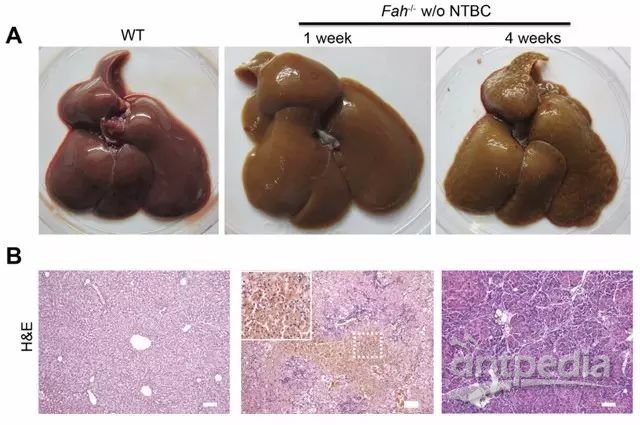
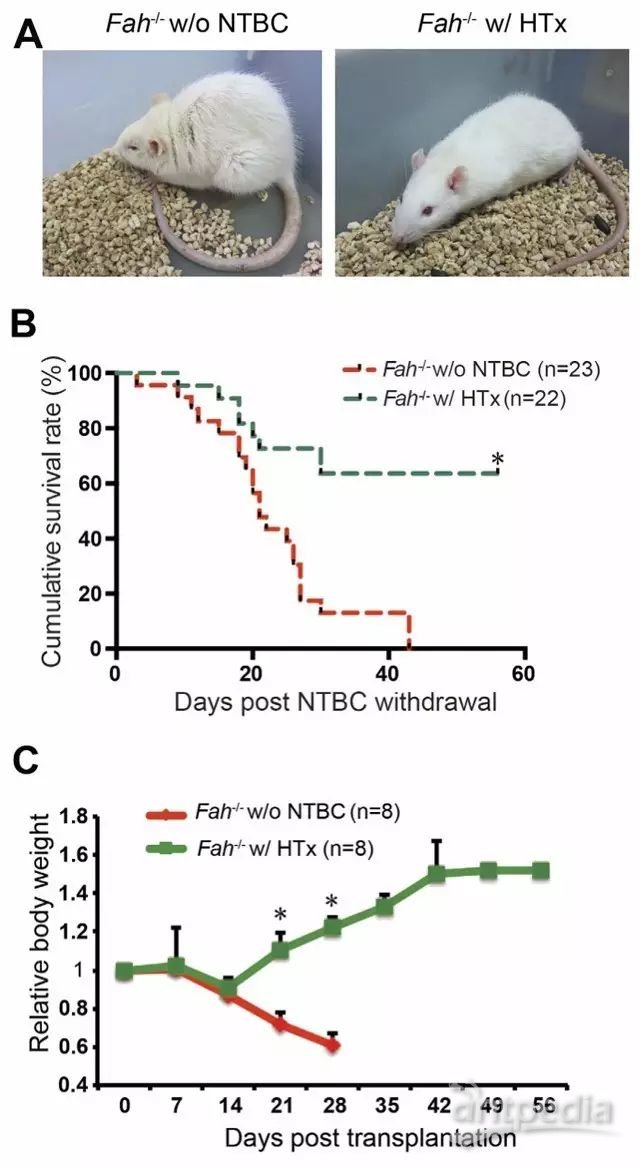
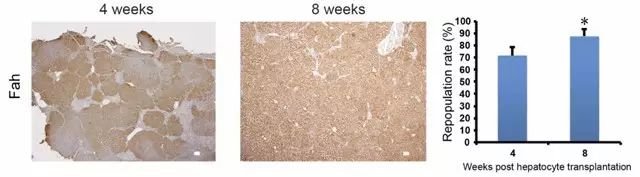
3. Fah-/-大鼠在肝细胞移植后提高肝功能和生存期[5]
参考文献:
[1] R. Berger, G. P. Smit, S. A. Stoker-de Vries, M. Duran, D. Ketting, and S. K. Wadman, 'Deficiency of Fumarylacetoacetase in a Patient with Hereditary Tyrosinemia', Clin Chim Acta, 114 (1981), 37-44.
[2] Mohan, N. et al. Indications and outcome of liver transplantation in tyrosinaemia type 1. European journal of pediatrics 158 Suppl 2,
S49–S54 (1999).
[3] Kuijk, E. W. et al. Generation and characterization of rat liver stem cell lines and their engraftment in a rat model of liver failure. Scientific reports 6, 22154, doi: 10.1038/srep22154 (2016).
[4] Hickey, R. D. et al. Efficient Production of Fah-Null Heterozygote Pigs by Chimeric Adeno-Associated Virus-Mediated Gene Knockout and Somatic Cell Nuclear Transfer. Hepatology 54, 1351–1359, doi: 10.1002/hep.24490 (2011).
[5] Zhang L, Shao Y, Li L, et al. Efficient liver repopulation of transplanted hepatocyte prevents cirrhosis in a rat model of hereditary tyrosinemia type I.[J]. Scientific Reports, 2016.