Nature | 菌群相关代谢物改善焦虑的脑肠轴机制
肠道菌群与宿主紧密合作,对机体的生理调节产生影响,尤其在脑部发育和功能调节以及自闭症、焦虑症、抑郁症等疾病中发挥着关键作用。临床研究显示大约3/4的自闭症患者同时伴有某些胃肠功能异常,这一现象促使科学家们探究肠道微生物与自闭症之间的潜在联系。近期研究表明,自闭症患者的肠道菌群与对照组存在显著差异,但微生物如何影响自闭症依旧是未解之谜。来自加州理工学院Sarkis Mazmanian团队筛选出了一个可能介导肠道菌群和自闭症的代谢物——4-乙基苯酚硫酸盐(4-ethylphenyl sulphate, 4EPS)。酪氨酸可以被肠道微生物群代谢成4EP,随后4EP在宿主磺基转移酶(SULT1A1)作用下生成4EPS。4EPS进入小鼠大脑,影响特定大脑区域的激活和连接,并破坏大脑中少突胶质细胞的成熟和髓鞘形成模式,进而调控小鼠大脑活动和焦虑样行为。相关成果发表于《Nature》。

1. 4EPS生物合成途径研究
先前研究发现非典型神经发育小鼠模型中代谢产物4EPS相对丰度较高,并且4EPS可以改变幼年小鼠野外试验中的行为。在自闭症谱系障碍患者(ASD)血浆中4EPS也是增加,同时在CNTNAP2小鼠ASD模型中4EPS的变化一致。由于无菌小鼠 (germ-free, GF) 中检测不到4EPS,由此推测,肠道微生物组的基因可以将酪氨酸转化为4EP,然后被宿主硫酸化为4EPS(图1a)。有研究显示,厚壁菌门(Firmicutes phylum)中一些罕见细菌可以利用对香豆酸(p-coumaric acid)产生4EP,而p-coumaric acid前体包括酪氨酸和一些植物性分子。事实上,以富含酪氨酸的鱼类为主的饮食和以大豆为主的饮食常规定殖小鼠中都可以检测到4EPS。通过筛选候选肠道细菌,研究者发现卵形拟杆菌Bacteroides ovatus(B.ovatus)可以将酪氨酸转化为p-coumaric acid。使用BLAST工具 (Basic Align ment Search Tool),在B.ovatus中鉴定出一个关键酶—酪氨酸解氨酶(BACOVA_01194),该酶的缺失将致使B.ovatus失去产生p-coumaric acid的能力(图1b)。研究者将B.ovatus和Lactobacillus plantarum(可将p-coumaric acid转化为4EP)共同定植于GF小鼠中,在小鼠尿液中仅能检测到低水平的4EPS。为了提高4EPS水平,对菌株进行工程改造, 改造后的B.ovatus菌株B.ovatus1194/PAD(MFA05)能将酪氨酸转化为中间产物4-乙烯基酚(4-vinylphenol),在与L.plantarum共培养的条件下,4-vinylphenol代谢为4EP。相反,B. ovatusΔ1194突变体(MFA01)与L. plantarum共培养时,不产生4EP(图1c,1d)。
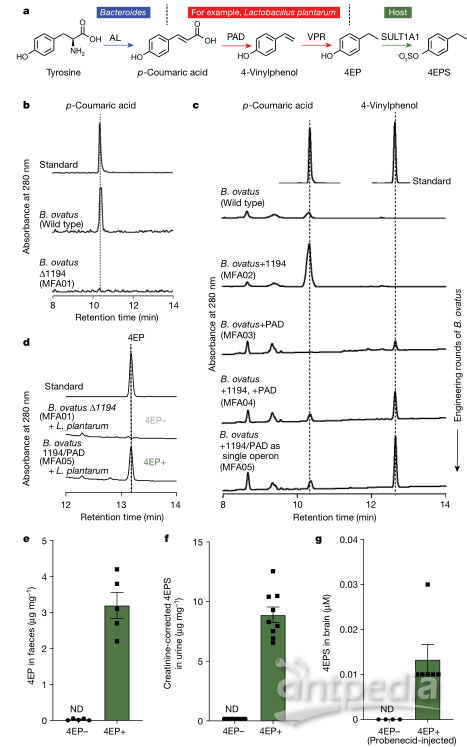
▲ 图1. 4EPS生物合成途径及菌种基因工程改造
2. 菌种定植小鼠4EPS研究
研究者在GF小鼠中分别定植B.ovatus1194/PAD和B.ovatusΔ1194菌株,进而获得4EP+和4EP-小鼠。与预期结果一致,4EP+小鼠粪便中可以检测到4EP(图1e),并且在其血清和尿液中检测到4EPS(图1f)。用丙磺舒(probenecid,抑制小分子通过血脑屏障外流的有机阴离子转运体)处理4EP+小鼠后,可以在其大脑中检测到4EPS,表明4EPS可以在大脑中积累(图1g)。4EP和4EPS是酚类分子,可能具有毒性或炎症特性。但4EP+和4EP-小鼠在体重或自由活动方面没有明显差异,菌群定植水平相似,同时4EP+小鼠没有表现出肠道功能障碍,结肠组织和血清中没有促炎反应。4EP+小鼠大脑中细胞因子趋向于抗炎,且4EP+小鼠中没有小胶质细胞激活的特征。表明研究者建立了一个简化的动物模型,该模型再现了与行为改变相关的肠道微生物代谢物暴露的自然途径。
3. 4EPS对大脑活动影响及机制研究
4EP(S)可能对各种器官都有影响,该研究中主要围绕大脑组织开展。通过功能超声成像评估4EP+和4EP-小鼠全脑功能连接差异:与4EP-小鼠相比,4EP+小鼠信号传导模式发生改变,主要发生在海马、丘脑、杏仁核、下丘脑、梨状体和皮层,提示4EPS升高与小鼠大脑各区域间功能连接异常有关。随后通过葡萄糖摄取实验比较了大脑的神经活动:4EP(S)与下丘脑亚区(前部、外侧和室旁核)、杏仁核(前部、基底外侧、中央和皮层)和终纹床核,以及丘脑室旁核的葡萄糖摄取增加有关。这些数据表明,4EP(S)会导致多个大脑区域的功能连接和活动改变,包括几个与边缘系统相关的区域。
为了探究4EP(S)影响大脑活动的分子机制,作者对4EP+和4EP-小鼠的六个脑区(PVT、基底外侧杏仁核、下丘脑、BNST、内侧前额叶皮层和腹侧海马体)进行mRNA测序分析。结果显示4EP(S)主要影响PVT基因表达,对BNST和基底外侧杏仁核的影响较小。与4EP-小鼠相比,4EP+小鼠PVT中神经元、新形成的少突胶质细胞和成熟少突胶质细胞特异性基因的表达降低,表明这些细胞类型的发育、丰度和/或活性的降低与4EP(S)有关。进一步分析发现,4EP+小鼠中未成熟的少突胶质细胞前体细胞增加,成熟少突胶质细胞减少,泛神经元标志物NeuN和泛少突胶质细胞标志物OLIG2水平保持不变,表明4EP(S)影响少突胶质细胞的成熟,而不是该谱系内细胞总数的变化。同时研究者发现4EP+小鼠全脑和胼胝体中神经元髓鞘形成减少。

▲ 图2. 定植产生4EP菌种对小鼠全脑功能连接和区域激活的影响

▲ 图3. 4EP+小鼠脑中少突胶质细胞成熟度降低
4. 4EP(S)可诱导焦虑样行为出现
研究者探究了肠道4EP(S)的产生是否可以调节小鼠行为,数据结果显示4EP(S)在几种常见行为学检测中均可以促进显著的焦虑样行为:(1)高架十字迷宫中,4EP+小鼠在开放臂末端停留时间更少;(2)旷场探索中,4EP+小鼠进入暴露区域的时间更少;(3)黑白箱实验中,4EP+小鼠在黑暗中停留时间更多。4EP+小鼠也表现掩埋行为增加,反映了焦虑和/或刻板行为特征。值得注意的是,富马酸氯马斯汀可促进少突胶质细胞成熟防止4EP+小鼠行为改变;使用咪康唑诱导髓鞘形成也可以改善4EP+小鼠的焦虑样行为,表明4EP(S)通过影响少突胶质细胞成熟调节小鼠的焦虑样行为。

▲ 图4. 4EP(S) 改变髓鞘形成和诱导焦虑样行为
小结
本文研究者发现了代谢物4EP(S)的生物合成途径,酪氨酸或其他膳食来源物质可作为前体被肠道菌群代谢成4EP;4EP在宿主磺基转移酶作用下被转化为4EPS,随后进入大脑,改变特定大脑区域的激活和连接,并破坏大脑中少突胶质细胞的成熟和髓鞘形成模式;肠道暴露于4EP会诱导小鼠产生多种情绪化行为。4EP(S)如何导致少突胶质细胞成熟和髓鞘化的变化以及如何影响行为等问题有待进一步明确。
参考文献
A gut-derived metabolite alters brain activity and anxiety behaviour in mice. Nature. 2022
请扫描下方二维码阅读原文

提取码:fdoj
绘谱帮你测
麦特绘谱拥有业内强大的Q600全定量代谢组、Q300全定量代谢组、Q200宏代谢组以及菌群相关的16S rDNA测序和宏基因组等方法,可提供代谢组学一站式整体解决方案,独家的检测技术、全面的数据报告以及专业的售后探讨,助力您的科研探索之路不断创新和突破。详情欢迎咨询麦特绘谱热线400-867-2686,获取详细资料!
往期推荐
1. Cell Metabolism | 菌群-脯氨酸代谢调控抑郁症
4. SCIENCE ADVANCES | 移植精神分裂症患者菌群诱导小鼠谷氨酸-谷氨酰胺-γ-氨基丁酸代谢异常
5. 贾伟/李后开: “肠道菌-胆汁酸-脑”代谢轴可能参与阿尔茨海默病和肝性脑病的发病机制