Nat Commun:内源性SUMO化修饰组学鉴定
编者按:
SUMO化修饰(Small Ubiquitin-like Modifiers),也就是我们常说的类泛素化修饰,是蛋白质翻译后修饰的一种,主要在核蛋白的组装、保持基因组完整性、调节胞内信号途径等方面发挥着重要的作用。近些年来SUMO化修饰的研究成为了生物学和生物医学领域一个日渐重要的课题,揭示出其在癌症治疗靶点、机理研究等众多疾病的发生/治疗方面的重要意义(如Cancer cell: SUMO化修饰—乳腺癌治疗新靶点)。然而,传统的蛋白组学方法研究内源性的SUMO化修饰存在众多问题,缺少一种能够大规模鉴定内源性SUMO化修饰的有效方法。
近日,来自丹麦哥本哈根大学的研究人员在国际著名期刊Nature Communication上报道了一种鉴定内源SUMO化修饰的新方法,研究揭示了人类细胞和器官中内源SUMO化修饰的差异和动态分布特征,也是迄今为止报道的最大通量的内源性SUMO化修饰组学,这为研究SUMO化修饰异常引起的癌症提供了有效策略。

关键词:SUMO化修饰、内源性SUMO2/3 蛋白组学、Lys-C和Asp-N
1
技术路线
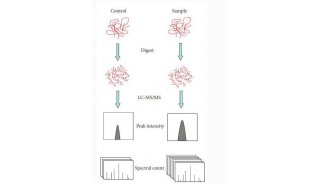
1、修饰肽段富集方法
SUMO家族有四个成员,SUMO1-4,其中SUMO2/SUMO3高度相似,通常写成SUMO2/3,蛋白激酶E1、E2、E3催化可逆的SUMO化修饰过程。
研究人员利用SUMO2/3 8A2对修饰肽段进行富集,由于传统组学的Trypsin/P的酶切方法会破坏该抗体的抗原表位,因此研究人员选择了Lys-C酶切,从而保证了抗原表位的完整性,SUMO-IP之后结合Asp-N的酶切方法,肽段大小保持在适合质谱鉴定的大小(1 kD),有效地提高了鉴定的通量。

图 1 修饰肽段富集策略
2、HEK细胞的SUMO化修饰
确认富集和纯化策略后,研究人员选取Control、热处理(Heat)和蛋白酶抑制剂MG132(MG132)处理的HEK细胞为研究对象,开展SUMO化蛋白组学研究。
结果共鉴定到14,869条特异性的SUMO2/3 修饰位点肽段,其中control组有4476个位点。Motif分析发现,发生SUMO化的肽段中,有24.9%赖氨酸存在于KxE motif中,60.1%的SUMO化修饰发生在该motif中,该motif为发生SUMO化的标志,表明该方法鉴定到的修饰位点不存在序列偏向性(图 2 a)。

图 2 SUMO化修饰位点的motif分析和位点统计
通过与前人报导的成果比较,此次鉴定到的内源性SUMO化位点数目是迄今最高的。实验鉴定到的位点中67.1%的肽段被报道过,score最高的10%的肽段中,88.2%的肽段被报道过,之间的差异可能来自于酶切方式的不同(图2 c)。而对于蛋白来说,比例分别为87.8%和99.9%(图 2 d),说明大部分的修饰位点存在于同一个蛋白上。总体证明该方法测序深度和灵敏度良好、修饰位点无序列偏向性,并且的鉴定结果完全可信。
2
研究速读
1、小鼠不同器官的SUMO化修饰组学
确定了定量方法的可行性和灵敏度后,研究者利用该方法测量了8个不同小鼠器官的SUMO化修饰组(图 3 a)。8个器官共鉴定到1963个位点,分布于955个蛋白上。组织之间的SUMO化位点有一定的差异,在肝脏中鉴定到的位点最多,有1131个,而在脑子和心脏中,鉴定到的位点最少,低于200个(图3 b),motif分析证明组织之间的结果和细胞具有一致性,但是不同组织之间略有差异。总体上证明细胞和器官之间,SUMO2/3靶向偏好性一致,但是组织之间的修饰位点和KxE的一致性略有差异。

图 3 小鼠组织的SUMO化修饰鉴定
2、不同器官中SUMO化蛋白的功能
为了研究不同组织之间SUMO化蛋白的功能,研究者利用label free方法做了SUMO化定量组学。共鉴定到1963个位点,955个蛋白,分别有46.3%和77.8%的蛋白被定量到,聚类分析和PCA分析显示除了良好的重复性(图 4 a b)。
功能富集结果显示,不同组织有其特定富集的功能,心脏中,SUMO化的肽段主要富集在心脏功能和发育相关的途径上,肝脏中则主要表现在与代谢相关的途径,包括氨基酸代谢和尿素循环等,在肺和脾等其他器官中也都富集到了特异性的功能和途径。
分析不同器官中蛋白丰度和修饰丰度的关系发现,只有心脏和肌肉中的SUMO化修饰和蛋白丰度相关,其他器官中,SUMO基本上都发生在蛋白丰度较低的蛋白上(图4 c),SUMO化修饰对蛋白丰度的依赖性比较低,再一次证明了不同器官中SUMO化修饰靶向蛋白和修饰方式的差异。

图 4 组织之间SUMO化修饰组学定量分析
3、人类细胞和器官SUMO化修饰的异同
为了探究SUMO化修饰在人类细胞和器官中的差异,研究者对发生SUMO化修饰的蛋白做了一系列的比较。研究发现在人类细胞和器官中,发生SUMO化修饰的蛋白集中分布在细胞核上(图5 a b),并且会同时发生磷酸化(图5 c d)。表明可能存在磷酸化和SUMO化的相互调节。但是SUMO化修饰的密度,HEK细胞明显高于器官。同时发现SUMO2/3平衡有巨大差异,表明在细胞和不同器官中,SUMO化修饰的整体需求差异显著。

图 5 细胞和器官中亚细胞定位、SUMO化-磷酸化共修饰情况
3小结
研究者利用Lys-C配合Asp-N酶切、SUMO2/3 8A2抗体富集SUMO化肽段结合LC-MS/MS鉴定,成功建立起人类HEK细胞和小鼠器官的内源SUMO化修饰组学研究方法。并且运用该方法揭示了人类细胞和小鼠器官内源SUMO化修饰分布、动态平衡和SUMO化功能的异同,为后人研究内源SUMO化修饰提供了可靠而有效的方法,使揭示SUMO化异常导致的癌症机理成为可能。
同时研究发现,机体中可能存在磷酸化和SUMO化的相互调节,这也启示我们通过分析不同的蛋白质修饰类型间的相互联系,可能为生命活动机理的揭示提供新的思路。如2017年Nature杂志首次报道GNAT家族组蛋白乙酰转移酶KAT2A能够和酮戊二酸脱氢酶复合体α-KGDH结合,在细胞核内形成复合体,行使其高特异性的琥珀酰转移酶的活性。(Face/Off---KAT2A一饰两角,在乙酰转移酶和琥珀酰转移酶间切换)
景杰生物作为全球蛋白质及翻译后修饰的领跑者,提供多种类、覆盖齐全的修饰组学服务,以包括磷酸化、泛素化修饰,巴豆酰化等新型酰化修饰的“一站式”蛋白质组学及修饰组学研究的解决方案,结合高灵敏度的修饰类抗体,助力研究工作。
参考文献
Hendriks Ivo A, et al. (2018), Site-specific characterization of endogenous SUMOylation across species and organs. Nat Commun.
更多阅读推荐
泛素化与昼夜节律:不舍昼夜---泛素化修饰与昼夜节律调控机制
SUMO修饰与癌症:Cancer cell: SUMO化修饰—乳腺癌治疗新靶点
Nat Commun:SUMO1修饰稳定CDK6蛋白 驱动胶质母细胞瘤进展
盘点:蛋白质组学在免疫学研究中的热点应用
珠联璧合:非编码RNA的蛋白质组学打开方式
2018年蛋白质组学JCR(期刊引用报告)
精准医学与蛋白组学
海量文献解读
行业前沿报导