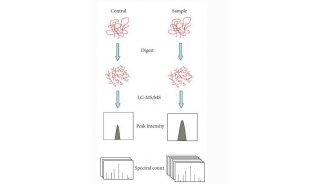
离子淌度分离概念的引入使得蛋白质组学进入了4D新时代。4D-蛋白质组学是在3D分离即保留时间(retention time)、质荷比(m/z)、离子强度(intensity)这三个维度的基础之上增加了第四个维度,离子淌度(mobility)的分离(图1),进而大幅度的提高扫描速度和检测灵敏度,带来蛋白质组学在鉴定深度、检测周期、定量准确性等性能的全面提升。
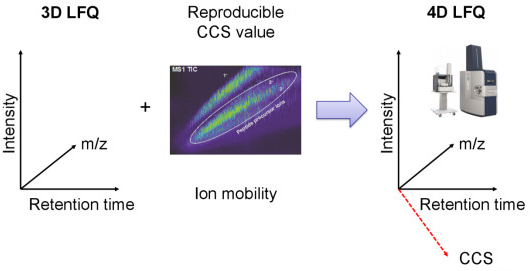
图1. 新一代4D-蛋白质组学示意图
更精准的修饰组学
蛋白质翻译后修饰(如磷酸化、糖基化、甲基化、乙酰化和泛素化等)调节着蛋白质的活性状态、定位、折叠以及蛋白质-蛋白质之间的交互作用等。许多至关重要的生命进程不仅由蛋白质的相对丰度控制,更重要的是被那些时空特异分布的翻译后修饰控制。因此, 除了对基因组所编码的“裸”蛋白质组的研究以外,更需要对经过翻译后修饰的蛋白质及蛋白质组的调控过程进行深入的研究。近年来,液相色谱与生物质谱联用技术为翻译后修饰蛋白质组学的发展提供了契机。然而,传统的质谱分析技术在蛋白质翻译后修饰研究中常面临着巨大的挑战,主要是因为: (1) 应用于蛋白质翻译后修饰的研究策略主要还是基于鸟枪法的蛋白组学,酶切极大提高了样本复杂度;(2) 翻译后修饰蛋白质在样本中含量低且动态范围广;(3)由修饰位点不同带来的同分异构多肽会在色谱上存在严重的共洗脱问题,而这些同分异构肽段在传统蛋白组学质谱平台上不能得到有效分离。随着质谱技术的发展,布鲁克推出的4D-蛋白质组学平台timsTOF Pro能在极大程度上改善以上三点问题。其原因主要是timsTOF Pro创新性地引入了双TIMS技术(捕集离子淌度技术)和PASEF技术(平行累积连续碎裂技术),仪器构造简介见图2A。它不仅在高效液相色谱和质谱之外,对复杂样品体系提供额外一个维度(淌度)的分离,提高了峰容量和化合物鉴定可信度;而且PASEF技术使得质谱在保证不损失灵敏度和分辨率的情况下,可以达到大于100Hz的扫描速度和将近100%的离子利用率。如图2B,timsTOF Pro在1.1秒的扫描循环内,可以采集到超过100张MS/MS谱图。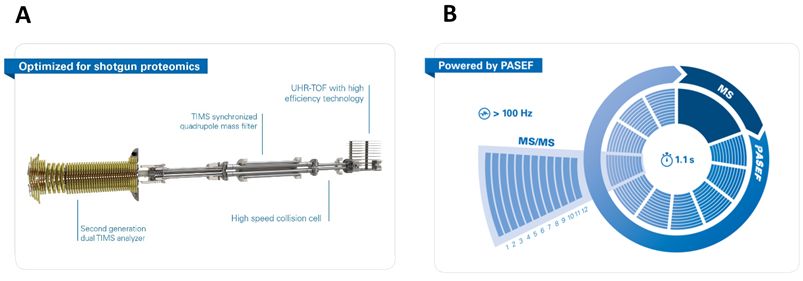
图 2. A. timsTOF Pro构造简介;B. timsTOF Pro单个扫描循环
当前已经有大量的数据显示出了timsTOF Pro的极佳灵敏度和蛋白覆盖深度,而最新数据显示,timsTOF Pro在蛋白翻译后修饰研究中也展示出其绝无仅有的优势,主要体现在大规模翻译后修饰鉴定和更精准的蛋白翻译后修饰定性定量分析。如图3展示了timsTOF Pro平台上分析不同蛋白翻译后修饰的鉴定结果。分析基本流程见图3A,小鼠肝脏提取蛋白分别用三种不同的PTMScan® kits (Cell Signaling Technology) 富集后,在timsTOF Pro平台上使用50分钟梯度进样分析,后续数据处理在PEAKS软件上完成。如图3B,在15mg蛋白富集起始量下,单针进样可以鉴定到782条unique酪氨酸磷酸化肽段,8804条unique赖氨酸乙酰化肽段,7199条unique 泛素化肽段。考察不同富集起始量下鉴定结果,可以发现即使在150μg蛋白富集起始量下,单针进样也能鉴定到63条unique酪氨酸磷酸化肽段,3465条unique赖氨酸乙酰化肽段,517条unique泛素化肽段,展现出仪器卓越的灵敏度。
图 3. A. 蛋白翻译后修饰分析基本流程;B. 不同蛋白富集起始量下各修饰鉴定数目
如图4展示了timsTOF Pro平台在组蛋白研究中的应用。组蛋白由Human293T cells经过酸提取得到,并进行丙酸酐处理和Trypsin酶切。后续用90min梯度进行分析,数据处理在PEAKS软件上完成。如图4,仅在270ng柱上样量下,单针进样就可以鉴定到241个protein groups和2146条unique peptides,展现出仪器卓越的灵敏度。

在翻译后修饰的研究过程中,经常会存在因修饰位点不同而导致的同分异构肽段现象,而对翻译后修饰发生位点实现准确定位以及不同修饰位点状态实现准确定量是揭示蛋白质复杂多样的生物功能的一个重要前提。面对这样微小的差别,传统的质谱鉴定和搜库软件通常难以做明确的区分,这就会导致出现错误定位(false localization)的问题。因此在处理PTM质谱数据时,需要对修饰位点进行FLR的控制。目前针对FLR的控制仍是一个挑战,主要是通过多种评估软件或算法来进行打分,但这些都是统计估算层面上的方法,并没有在质谱鉴定水平上解决修饰位点准确定位的问题。

强大的timsTOF Pro平台因其超高淌度分辨率,为同分异构肽段的分离提供了更多可能。在保持着超高灵敏度和扫描速度情况下,多一维淌度分离极大提高了峰容量,淌度信息也使得鉴定结果更可靠。如图5A,为保留时间43.01min/质荷比951.537的EIM(Extracted Ion Mobilogram)图,可以发现两条共洗脱的同分异构肽段在淌度管里得到了良好的分离(淌度分辨率~120),通过EIM图中峰面积可实现两种不同修饰位点状态的准确定量,乙酰化肽段(CCS=424.4Å2)丰度约为乙酰化肽段(CCS=433.5Å2)的1.8倍。淌度的有效分离使得两条肽段分别得到了干净的二级谱图,通过图5B的MS/MS谱图可以对乙酰化位点实现准确定位,图5B上方的二级图对应乙酰化肽段FKDIFQEITDK(42.02)K;图5B下方的二级图对应乙酰化肽段FK(42.02)DIFQEITDKK。图5C则展示了共洗脱的组蛋白同分异构肽段在淌度管内得到了良好的分离,由图5D二级谱图确证修饰肽段信息分别为:图5D上方二级图对应肽段信息为G(+56.03)K(+14.02)QGGK(+42.01)AR(+14.02),肽段上修饰有丙酰化、甲基化、乙酰化;图5D下方二级图对应肽段信息为G(+56.03)K(+14.02)QGGK(+56.03)AR,肽段上修饰有丙酰化、甲基化。
综上,4D-蛋白质组学除了在蛋白质组分析方面展现出极佳的灵敏度和覆盖深度,同时多一维淌度分离极大提高峰容量和同分异构肽段分离能力,这将有利于实现更精确的翻译后修饰位点定位和准确定量,相信4D-蛋白质组学将在精准修饰蛋白组学研究中有着广阔的应用前景。
参考文献:
1. Matthew Willetts,et al., High Sensitivity PTM Characterization in Complex Cell Lysates Using Trapped Ion Mobility. ASMS 2019, Poster TP630
2. Shourjo Ghose,et al., Analysis of Histones from HEK293T Cells using a QTOF with Trapped Ion Mobility and PASEF Workflows. ASMS 2019, Poster TP642

▼▼点击“阅读原文”,ASMS 2019 海报集锦