复杂多肽样品处理案例分享——β-淀粉样蛋白多肽的纯化进阶之路
在多肽研究领域,复杂多肽往往具有较高研究价值,但由于其结构的繁杂性,处理起来也比较困难,不管是对合成,纯化还是最终的分析检测,其实难度都是成倍数增加,但科学实验就需要我们进行难题的攻克!Biotage 一直致力于多肽药物的合成以及纯化研究,为您提供相应的合成纯化解决方案。我们将用一个特别难处理的肽作为一个案例,为您提供一些提高纯化效率的思路和策略。
对于此β-淀粉样蛋白多肽,在药物多肽邻域,其结构比较复杂,含有大量疏水性氨基酸,并且许多氨基酸沿着40或42个氨基酸的长度成片聚集在一起,因此合成它们很有挑战性。同时在脱保护之后,由于这些肽溶解度很小,在溶液中很容易聚集或纤维化,因此极难纯化。
此次我们使用Biotage® Initiator+ Alstra™多肽合成系统,合成了β-淀粉样蛋白1-40 。在研究和优化了合成方案之后,我们毫不费力地得到了相当不错的合成结果,如图1所示。

图1.溶于DMSO的合成A-β1-40的粗分析HPLC。主要产品是所需的含有大量氧化后的多肽(O)产品。并且我们并没有采取任何措施来减少在合成或树脂裂解过程中发生的Met氧化。
目前最新的研究已经发布了通过重新溶解一些关于在溶液中重新溶解纯化后的β-淀粉样蛋白而产生对应单肽的指导方法,
我们决定按照发布的指导方法溶解我的粗肽样品,而不是尝试发明一种新方法。通过这些实验,我想评估两种溶解策略——DMSO和碱性水溶液。我们需要考虑的一个重要因素是流动相改性剂(调节pH值),完全单体的可溶性多肽一旦和色谱柱接触时,它们很可能会立即聚集,从而不利于纯化。因此起先我们用TFA调节调节pH值做了一些实验,发现其效果一般,随后我们将流动相改性剂改为0.1%NH4OH用于最终的实际纯化实验。
在纯化开始阶段,我们对梯度进行了一些优化,起始我们使用最简单的梯度洗脱,通过对粗产物的分析,我们发现阶梯式梯度效果更好,一般来说阶梯式梯度的效果会好于常规的梯度洗脱;
最后我们把大约100mg的粗品溶解在500µL的DSMO中,通过注射器湿法上样后纯化,如图2所示。
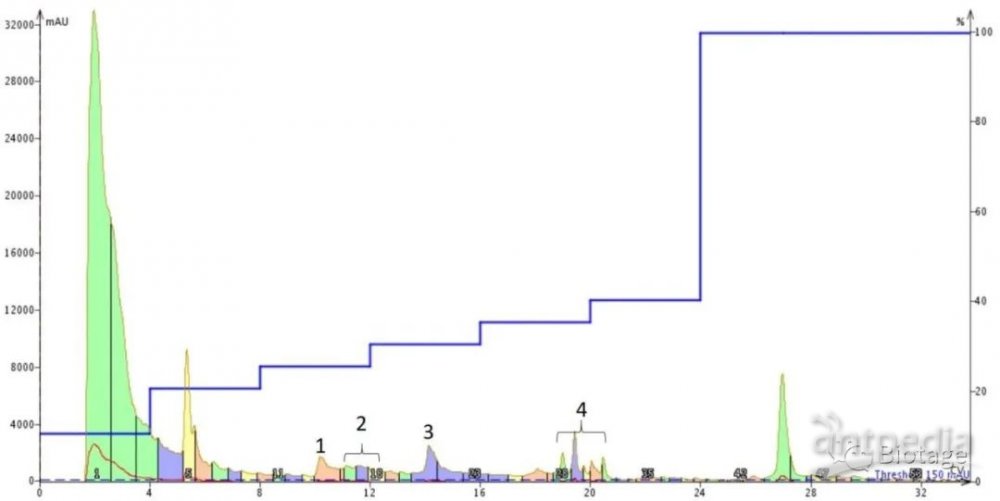
图2.使用阶梯式梯度方法进行多肽分子Aβ1-40的Flash纯化谱图。图中四个峰为后期分析后标记出来的四个产物组分峰。系统:Isolera™Dalton 2000,色谱柱:Sfar Bio C18。
说实话,这个色谱图让我有些惊讶。注入的DMSO溶液是完全透明的,表明它没有发生聚集。然而,峰的形状和数目却表明并非如此。我决定浓缩部分溶液,并对每个标记峰的相对纯度进行研究,如图3所示。

图3:峰1、峰2、峰3和峰4的HPLC样品分析对比图。如预期,峰1主要为多肽的氧化产物,而其他三个峰含有所需肽的浓度则有所下降。另外,峰2和峰3的HPLC组成几乎相同。
可以发现,所有组分都含有氧化肽和目标多肽,只是浓度不同。氧化肽的存在可能源于以下几个原因:
• 纯化本身分离度不高
• 纯化完成,后处理期间目标多肽发生了氧化
• 纯化过程中,氧化肽与目标肽产生了聚集
特别是峰2和峰3,氧化肽:目标肽的比例(ox:pdt)几乎相同,而最显著的差异是,峰3样品中的产物峰更宽。这个因素虽小,但不容忽视。尽管这两个样品的分析成分相似,但在初始纯化过程中,它们的色谱行为却大相径庭-特别是峰2。色谱差异表明这两个样品很可能存在构象或低聚差异。很遗憾,目前的工具,我们无法确定这些构象差异是什么。
随后,我们决定进行第二次纯化,此次,我将乙腈作为溶剂的一部分。结果侧链保护基团仍然以固体形式存在,降低了其在水中的溶解度。这种情况下,样品几乎会立即形成凝胶(早期聚集和可能的纤维化)。通过溶于溶于25%的MeCN(aq)+1%NH4OH溶液中,使用相同的方法和粗品量,我们会会得到完全不同的Flash纯化谱图,如图4所示。

图4.将粗品溶解在溶解在25%MeCN(aq)+ 1%NH4OH溶液中,使用阶梯式梯度方法进行多肽分子Aβ1-40的Flash纯化谱图。图中四个峰为后期分析后标记出来的四个产物组分峰。系统:Isolera™Dalton 2000,色谱柱:Sfar Bio C18。
与之前一样,峰的数量仍然比原始分析所预期的要多。但是,考虑到聚集(胶凝)效应,这个结果就不奇怪了。但重要的是峰的形状改善了,这表明溶液中存在的构象差异较少,整体纯化效率可能得到了提高。对四个标记峰进行进一步分析,如图5所示。

图5. 峰1、峰2、峰3和峰4的HPLC样品分析对比图。
如预期,峰1含有大量的氧化产物,而峰2主要含有目标多肽和以及一部分氧化产物。其余两个峰也含有氧化产物和目标产物的混合物,但相对浓度有所增加。根据峰保留时间以及对应的极性的增加,我们判断峰3和4可能是所需肽的不同低聚形态。
从第二次改进的进样方式所得到的图谱可以发现,效果得到了改善,更符合我对粗略分析色谱图的预期。峰1含有大量氧化肽和目标产物肽,同时我们发现峰2基本上是所需目标产物,表明这可能是单体目标产物,基于这些结果,我们可以发现这组溶剂纯化条件肯定比DMSO溶剂的纯化效率更高。
最后,我们决定使用1% NH4OH(aq)溶解约100mg粗肽样品,然后将其进行纯化,如图6所示。通过将样品快速的稀释到缓冲溶液当中不仅打破了预先形成的低聚体,而且可以最大程度地将样品保持单体状态。

图6. 将粗品溶解在溶解在1%NH4OH(aq)溶液中,使用阶梯式梯度方法进行多肽分子Aβ1-40的Flash纯化谱图。得到了三个主要的色谱峰。系统:Isolera™Dalton 2000,色谱柱:Sfar Bio C18。
变化非常明显,样品已经由原来的四个峰缩短至三个峰;相比以前的纯化实验,峰的形状和分离度甚至有所提高。虽然在纯化开始前溶解的样品有一点浑浊,但对分离实验没有什么影响。与之前两种纯化方法相比,这次图谱里面的峰的色谱的“不良行为”最少。
随后我们将三个标记的峰浓缩并通过分析HPLC进行评估,如图7所示。

图7. 峰1、峰2和峰3的 HPLC样品分析对比图。
可以看到虽然峰1和峰3保留率有显著差异,但是含有的成分几乎相同。与之前的纯化一样,第一个峰是由于氧化物而产生,并且和目标肽有一定的交叉。值得注意的是,目标多肽在峰2中的含量是三个方法中比例最高的,这可以当作一种后期方法改进的参考变量。
我们希望通过这些对于数据来说明,在纯化前考虑纯化效率时,选择溶剂以及对应的溶剂条件往往十分重要。纯化工作已经成为大多数多肽团队的瓶颈,行动之前多查阅文献,多思考或者和我们沟通和交流,都有助于解决一些可能出现的纯化问题,甚至解决由于产量低而导致的后期再合成问题。
如果你想了解更多关于这方面的问题,以及了解其他可以提高你的多肽纯化效率的策略,欢迎留言和我们联系。