项目文章 | IF=22!新冠患者肠道微生物功能受损的后遗症研究


● 期刊:Gastroenterology
● 影响因子:22.682
● 发表时间:2021.10.20
2021年10月20日,香港中文大学医学院、肠道菌群研究中心黄秀娟(NGSiew Chien)课题组张芬和万亚婷(共同一作),在Gastroenterology(IF22.682)期刊发表了题为“ProlongedImpairment of Short-Chain Fatty Acid andL-IsoleucineBiosynthesis in Gut Microbiome in PatientsWithCOVID-19”的研究论文。该研究发现COVID-19在疾病缓解前后的肠道微生物功能发生紊乱,包括短链脂肪酸和L-异亮氨酸生物合成减少。补充短链脂肪酸或L-异亮氨酸的策略可能会改善疾病的结局。迈维代谢为该研究提供了基于GC-MS靶向短链脂肪酸检测和LC-MS靶向L-异亮氨酸检测分析的技术支持。

背景和目的:由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)感染引起的冠状病毒病(COVID-19)与肠道微生物组成改变有关。作者对COVID-19患者在疾病缓解前后的肠道微生物组功能进行了表征,并检测了粪便代谢物。
新发现:COVID-19患者的肠道微生物群中短链脂肪酸(SCFA)和L-异亮氨酸生物合成能力受损,康复后持续存在,并与疾病严重程度和宿主免疫反应相关。
局限性:这是一项观察性研究,没有明确的因果关系。肠道微生物组功能的这些变化是否会直接影响COVID-19的严重程度,还需要进一步研究。
影响:这些发现表明COVID-19在疾病缓解前后的肠道微生物功能发生紊乱,包括短链脂肪酸和L-异亮氨酸生物合成减少。补充短链脂肪酸或L-异亮氨酸的策略可能会改善疾病的结局。
2021年11月16日,Gastroenterology期刊社评:COVID-19和被遗忘的器官——肠道微生物组代谢输出的长期变化。

■ ■ ■ ■ ■
图1所示。尽管病毒清除后症状恢复,但COVID-19感染的严重程度与肠道微生物代谢持续受损有关。在COVID-19重症患者中,涉及短链脂肪酸和L-异亮氨酸生物合成的通路明显受损。
由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)感染引起的冠状病毒病2019(COVID-19)与肠道微生物组成改变有关。在SARS-CoV-2感染患者中,参与短链脂肪酸(SCFAs)代谢的肠道细菌的系统发育群减少。作者的目的是描述COVID-19患者在疾病治疗之前和之后肠道微生物群的功能特征。
在本研究中,作者前瞻性招募了66名使用抗生素治疗的COVID-19患者,并对他们从入院到出院后30天进行随访。利用宏基因组分析,对与疾病严重程度和免疫反应相关的肠道微生物群功能的改变和纵向动力学进行了表征。采用靶向代谢组学分析来检测粪便微生物代谢产物的变化进一步验证。
●COVID-19受试者。纳入标准:SARS-CoV-2逆转录聚合酶链反应阳性、入院情况、入组前3个月内未使用益生菌、益生元、抗生素。根据症状将患者分为4个不同严重程度组:无肺炎影像学指征者为轻度;有肺炎伴发热及呼吸道症状者为中度;呼吸频率≥30次/分,呼吸空气时血氧饱和度≤93%者为重度,或氧合指数(PaO2/FiO2)≤300mmHg; 出现呼吸衰竭需要机械通气或器官衰竭需要重症监护为危急重症。收集住院患者的血液和粪便,出院患者随访时收集粪便。血液分离出血浆用于临床生化指标检测,粪便用于宏基因组测序和代谢组检测。
●因社区获得性肺炎住院的肺炎对照组。纳入标准包括:SARSCoV-2逆转录聚合酶链反应-呼吸标本阴性,18岁以上,住院治疗入组前3个月内未使用益生菌、益生元或抗生素。

4.1 受试者的临床特点
确诊的SARS-CoV-2住院患者66例和70名年龄和性别匹配的对照组(非COVID-19)进行了研究,人口学、临床特征和粪便收集时间表见表1和图1。COVID-19患者住院时间中位数为24天。35例患者出院后随访。所有患者均未使用抗生素,35例(53.0%)患者接受至少1种抗病毒药物治疗。入院时发热35例(53.0%),腹泻8例(12.1%),至少1种呼吸道症状47例(71.2%)。根据COVID-19严重程度分级标准,危重症患者(6.1%;N¼4)、重症(22.7%;N¼15),中等(24.2%;N¼16),轻度(47.0%;n¼31)。
表1.COVID-19病例和非COVID-19对照者的临床特征

■ ■ ■ ■ ■
图1.COVID-19患者粪便样本采集和住院时间示意图(n=66)。CoV表示COVID-19患者。“D0”表示患者报告发病时间。
4.2 COVID-19患者肠道微生物组功能变化
为了了解SARS-CoV-2感染如何影响抗生素治疗的COVID-19患者的肠道微生物群,对COVID-19患者和对照组的粪便样本进行了宏基因组测序,并对粪便微生物群进行了分类分析。首先在基线时(入院后第一次采集粪便样本)研究了轻、中、重症/危重型COVID-19患者的肠道菌群组成。COVID-19重症/危重症患者的菌群组成与非COVID-19对照组明显不同(补充图1A),他们与对照组的Bray-Curtis差异显著高于非COVID-19个体(补充图1B)。与非COVID-19对照组相比,COVID-19患者的主要特征是青春双歧杆菌、布氏瘤胃球菌和普拉梭菌损耗,卵形拟杆菌、多雷氏拟杆菌和多形拟杆菌富集。这些结果提示SARS-COV-2感染与肠道微生物组成的改变有关。
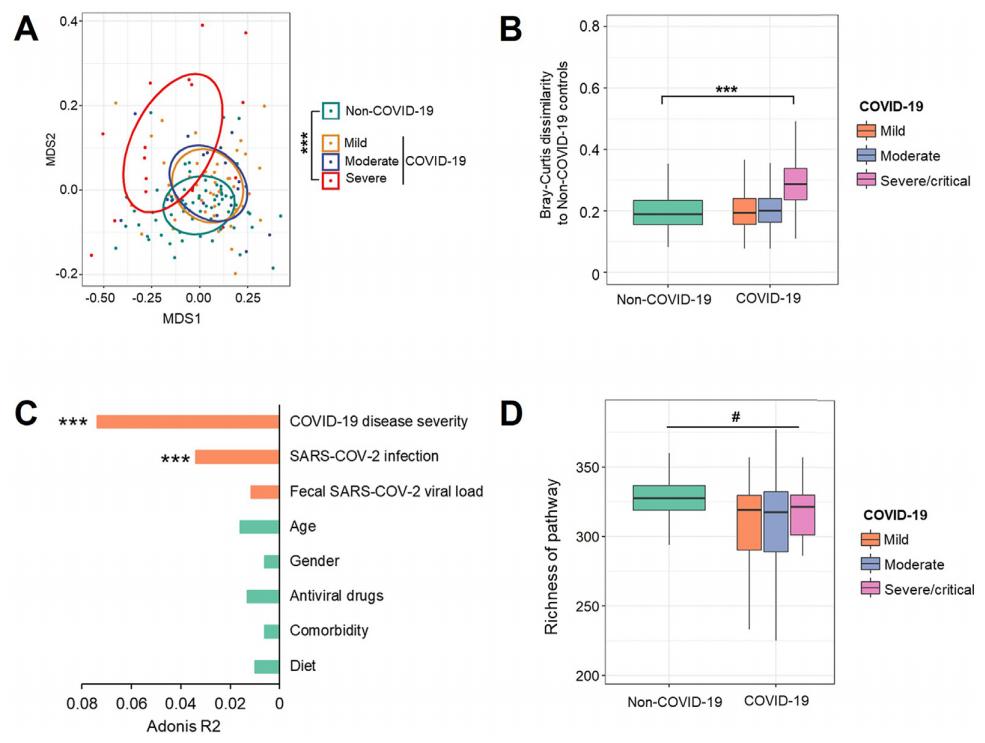
由于COVID-19和非COVID-19受试者的肠道微生物组成存在差异,通过分析肠道微生物组的功能,包括功能基因丰度及其相应的通路,来研究这些组成差异是否转化为功能水平的差异。首先在基线时(入院后采集的第一次粪便样本)调查了轻、中、重症/危重症COVID-19患者的微生物通路组成,排除SARS-CoV-2清除后收集第一次粪便样本的患者。COVID-19重症/危重症患者的微生物通路组成与非COVID-19对照组明显不同(图2A),他们与对照组的Bray-Curtis差异显著高于非COVID-19个体(图2B)。在检测的所有宿主因素(年龄、性别、共病、COVID-19疾病严重程度、粪便SARS-CoV-2病毒载量、抗病毒药物和饮食)中,SARS-CoV-2感染和COVID-19疾病严重程度均显著影响微生物功能通路的组成,其中COVID-19疾病严重程度的效应量最大(图2C)。住院期间的饮食对微生物功能途径的变化没有显著影响(图2C)。此外,与非COVID-19对照组相比,COVID-19患者粪便中微生物功能通路的丰度显著降低(图2D)。这些结果表明,SARS-COV-2感染也与肠道微生物群功能通路的改变有关。
 ■ ■ ■ ■ ■
■ ■ ■ ■ ■
图2. COVID-19患者基线时肠道微生物组功能变化
A. 采用基于Bray-Curtis差异的非度量多维尺度图(NMDS)分析COVID-19轻、中、重症/危重症患者和非COVID-19患者的微生物功能通路组成。***表示P < .001。
B. 基于Bray-Curtis分析COVID-19轻、中、重症/危重症患者与非COVID-19对照组的多个通路差异。***表示为P < .001。
C. 宿主因子对微生物功能通路组成的影响大小。*、**、***分别表示P < .05、P < .01、P < .001。
D. 基于Chao1指数评估COVID-19轻、中、重症/危重症患者和非COVID-19患者的微生物通路丰富度。#表示P < .05。

■ ■ ■ ■ ■
补充图2. COVID-19患者住院期间肠道微生物菌群组成改变
A. 采用基于Bray-Curtis的NMDS图观察COVID-19轻、中、重症/危重症患者和非COVID-19患者肠道微生物群落的分类组成。
B. 基于物种相对丰度的COVID-19轻、中、重症/危重症患者与非COVID-19对照者的Bray-Curtis差异。
4.3 有益微生物功能的消耗及其与COVID-19严重程度的相关性
接下来研究了哪些微生物功能主要驱动COVID-19患者和非COVID-19对照组的差异。与非COVID-19对照组相比,19个微生物通路在基线时损耗,19个途径在COVID-19患者的粪便样本中富集,这些样本使用DESeq2确定(所有校正P<.05),使用MaAalin2调整年龄和性别(所有校正P<.05)。COVID-19患者的19个衰竭通路中,有7个与碳水化合物降解有关,表明SARS-CoV-2感染损害了肠道微生物降解碳水化合物的能力。在COVID-19患者中,与非COVID-19对照组相比,参与乙酸生物合成的双歧杆菌支路途径减少最多(2.4倍),而尿素循环途径增加最多(2.3倍)。这些数据表明,COVID-19患者短链脂肪酸的生产能力受损,尿素循环能力增强。通过MaAsLin2分析,将38个不同的通路与COVID-19疾病的严重程度相关联,调整年龄、性别和共病,11个主要与糖衍生物降解、L-异亮氨酸生物合成和嘌呤核苷酸生物合成相关的微生物通路,与COVID-19严重程度呈显著负相关(表2;FDR,校正P<.2);以及与碳水化合物生物合成、嘌呤核苷酸生物合成、血红素生物合成和肽聚糖生物合成相关的8个微生物途径,与COVID-19严重程度显著正相关(表2;FDR校正P< .2)。蔗糖衍生物的降解与短链脂肪酸发酵的关键代谢产物丙酮酸盐的生成有关。L-异亮氨酸是微生物与宿主相互交流的重要媒介,在调节宿主先天免疫和适应性免疫中发挥重要作用。COVID-19患者肠道微生物功能的改变可能对宿主的生理和功能产生重大影响。
为了确定住院是否可能导致肠道微生物群的变化,作者还纳入了因社区获得性肺炎住院但COVID-19阴性的患者。研究发现,与肺炎患者相比,COVID-19患者的肠道微生物群功能有显著不同(补充图3)。通过比较COVID-19和非COVID-19对照,确定了38个富集或消耗的微生物通路。COVID-19和肺炎患者之间也21条通路(51%)存在差异,包括与粪便中短链脂肪酸合成和异亮氨酸生产相关的途径。这些数据表明,COVID-19患者肠道微生物组功能的改变不太可能是住院的结果。
表2.微生物通路与疾病严重程度显著相关


■ ■ ■ ■ ■
补充图2. COVID-19患者和住院肺炎对照者微生物功能通路组成。NMDS图基于Bray-Curtis差异分析。
4.4 短链脂肪酸微生物功能和L-异亮氨酸生物合成与血浆指标的相关性
SARS-CoV-2感染可引起COVID-19患者免疫功能失调,进而引发细胞因子风暴并发症导致更严重疾病后果。研究发现血浆NT-proBNP、IL10、CXCL10、LDH、CRP和丙氨酸转氨酶水平升高,血小板计数(PLT)、白蛋白和血红蛋白水平降低,这与更严重的COVID-19患者症状显著相关,提示SARS-CoV-2感染可能引起这些变化,从而导致更严重的疾病结局。然后,将血液指标的这些变化(CXCL-10,IL10, NTproBNP, LDH,CRP,丙氨酸转氨酶,PLT和白蛋白)与发现的微生物功能联系起来(表2),评估微生物功能是否在免疫应答失调中发挥作用。SCFA产生的四种途径(D-半乳糖酸降解I、己糖醛酸和己糖醛酸超降解途径、β-D-葡萄糖醛酸超降解途径、4-deoxy-L-threo-hex-4-enopyranuronate降解途径)均与NT-proBNP呈显著负相关(图3)。L-异亮氨酸生物合成途径I与血浆CXCL-10和c反应蛋白水平呈负相关(图3)。NTproBNP是心衰标志物,与COVID-19患者更多的不良临床结果相关,这一指标在住院期间死亡的患者中显著增加。CXCL10是一种促炎趋化因子,已知与COVID-19的不良预后相关。血浆CRP水平升高是对炎症的响应。这些通路可能参与预防COVID-19过度侵袭性炎症。相比之下,尿素循环途径与CXCL-10呈正相关,血红素生物合成途径II与PLT呈负相关(图3)。这两种途径的过表达可能与更多的功能失调的免疫反应相关。总之,数据显示,肠道微生物群可能在功能上校准宿主对SARS-CoV-2感染的免疫,从而影响COVID-19的严重程度。
 ■ ■ ■ ■ ■
■ ■ ■ ■ ■
图3. 微生物通路和血浆指标之间的斯皮尔曼相关性。蓝色圆圈和正值表示正相关,红色圆圈和负值表示负相关。大小和阴影表明相关性的大小,其中较深的阴影显示的相关性高于较浅的阴影。
4.5 COVID-19恢复后短链脂肪酸和L-异亮氨酸生物合成的微生物功能长期受损
为探讨患者康复后肠道菌群及其功能是否恢复,收集35例患者出院后的粪便样本(轻症15例,中度17例,重症13例,见图1)。重症/危重症患者与非COVID-19对照组相比,在疾病康复后,尽管微生物途径的富集程度可以增加到非COVID-19对照组的可比水平(图4C),但是康复患者的微生物组成和功能仍表现出明显不同(补充图2A及B及图4A及B)。进一步研究了COVID-19患者在疾病康复后差异菌群分类或功能通路是否恢复了(表2),与非COVID-19对照组相比,包括青春期双歧杆菌、溴化瘤胃球菌和prausnitzii在内的7种细菌类群在患者基线样本中降低,出院后显示出可持续的低丰度。然而,即使在疾病消除后,基线富集的拟杆菌属(Bacteroidesthetaomicron)和拟杆菌属(Bacteroidescaccae)在COVID-19患者中仍比非COVID-19对照组显示出更高的丰度(补充图2C)。在微生物功能方面,重症患者的基线样本中,所有过度富集的通路在出院后都恢复到与非COVID-19对照组相当的水平。相比之下,参与SCFA和L-异亮氨酸生物合成的11个通路中,有9个在病情缓解后出现持续损耗(图4D)。这些数据表明,在COVID-19康复后,患者的肠道微生物组功能持续受损。


■ ■ ■ ■ ■
图4. COVID-19恢复后短链脂肪酸和L-异亮氨酸生物合成的微生物功能长期受损。
A. 使用基于Bray-Curtis差异的NMDS图观察非COVID-19对照组和COVID-19患者基线和出院后的微生物通路组成。
B. COVID-19患者基线和出院后与非COVID-19对照组的Bray-Curtis差异。采用Mann-Whitney U检验确定显著性P值,表示为*P < .05。
C. 基于Chao1指数评估非COVID-19对照组和COVID-19患者基线和出院后的微生物通路富集程度。采用Mann-Whitney U检验,#P < .05表明COVID-19患者与非COVID-19对照组相比具有统计学意义。
D. COVID-19患者出院后肠道微生物功能变化热图。右边的标签显示了微生物的通路。相对丰度高的通路为红色,而相对丰度低的通路为蓝色。

■ ■ ■ ■ ■
补充图2. COVID-19患者康复后肠道微生物菌群组成改变。
A. 非COVID-19对照组和COVID-19患者基线和出院后的肠道菌群组成,采用基于Bray-Curtis的NMDS图。
B. 基于物种相对丰度的COVID-19患者在基线和出院后与非COVID-19对照组的Bray-Curtis差异。
C. COVID-19患者出院后肠道菌群物种水平变化热图。
4.6 COVID-19粪便中短链脂肪酸和异亮氨酸浓度降低
粪便代谢组提供了微生物活性的功能指数,并可被用作介导宿主-微生物组相互作用的媒介。肠道微生物功能的变化与肠道微生物代谢产物的变化是一致的。在COVID-19患者中,与短链脂肪酸和L-异亮氨酸产生相关的几个途径被消耗,尤其是那些重症/危重症患者。在基线时(入院后采集的第一个粪便样本),COVID-19重症/危重症患者的粪便含量显著低于非COVID-19对照组(图5A-G)。COVID-19患者的L-异亮氨酸浓度也低于对照组(图5h)。这些结果进一步表明,SARS-CoV-2感染可能与肠道微生物产生短链脂肪酸和L-异亮氨酸生物合成能力受损有关。有趣的是,在疾病缓解30天后,重症/危重症患者的丁酸、戊酸、己酸和L-异亮氨酸浓度仍显著降低,这支持了SARS-CoV-2感染可能对肠道微生物组功能造成长期影响的观点。此外,作者发现COVID-19患者粪便丁酸水平与血浆IL10、CXCL-10、CRP呈显著负相关,与白蛋白呈显著正相关(补充图4)。L-异亮氨酸与CXCL-10呈负相关,与PLT呈正相关(补充图4)。这些结果表明,微生物来源的丁酸盐和L-异亮氨酸可能参与了预防COVID-19过度炎症的过程。


■ ■ ■ ■ ■
图5. 粪便中乙酸(A)、丙酸(B)、丁酸(C)、戊酸(D)、己酸(E)、异丁酸(F)、异戊酸(G)、和L-异亮氨酸(H)在COVID-19患者和非COVID-19对照组中的比较。入院后第一次采集的粪便样本(基线组)和出院后采集的粪便样本(康复后组)用于目标代谢组分析。

■ ■ ■ ■ ■
补充图4.粪便代谢物和血浆指标之间的Spearman相关性。这些血浆指标与疾病严重程度显著相关。蓝色圆圈和正值表示正相关,红色圆圈和负值表示负相关。大小和阴影表明相关性的大小,其中较深的阴影显示的相关性高于较浅的阴影。
作者进一步研究了哪些细菌对这些微生物通路的改变贡献最大。这些通路中没有一个是由单一物种主导的,这表明这些通路的改变可能是由于它们在群落水平上功能的改变(补充图5)。值得注意的是,Fprausnitzii细菌是SCFA产生通路(补充图5A-D)和L-异亮氨酸产生通路(补充图5E和F),提示Fprausnitzii可能在对抗SARS-CoV-2感染中发挥有益作用。




■ ■ ■ ■ ■
补充图5. COVID-19基线和非COVID-19粪便样本中微生物对微生物通路的贡献。利用Deseq2的相对对数表达对微生物通路丰度进行归一化处理。
COVID-19患者即使在康复之后,肠道微生物组SCFA和L-异亮氨酸合成能力仍然存在受损的情况。这两种微生物功能代谢物与宿主免疫反应相关,凸显了肠道微生物功能在SARS-CoV-2感染发病机制和结局中的重要性。这是第一个描述COVID-19中整个肠道微生物群落的功能潜力和代谢输出的研究,有助于支持基于微生物群的COVID-19疗法的开发。
 科研延伸
科研延伸
本文采用短链脂肪酸和靶向检测(针对具体关注的代谢物开发针对性方法进行检测),针对肠道菌群功能代谢物检测,迈维代谢推出的T500,即靶向检测500多种代谢物,适合肠道菌群功能性代谢物研究,具有以下三大优势:
覆盖率广:500+种物质,包含9大代谢通路
定性准确:500+种标准品,一一对应,假阳性率低于1%
绝对定量:500+条标准曲线,R2大于0.99

99%的代谢组学研究者都在阅读下文:
●重磅综述 | 如何完善微生物组与疾病之间的证据链?从相关性到因果关系的5个层次
●喜讯!迈维代谢斥资千万成为第一家引进timsTOF fleX的第三方科研服务公司

客服微信:18062045271
咨询电话:027-62433042
邮箱:support@metware.cn
网址:www.metware.cn
我就知道你“在看”