文献解读 | 脂质组学及质谱成像解析环境污染物对小鼠肝毒性

Hepatotoxic effects of inhalation exposure to polycyclic aromatic hydrocarbons on lipid metabolism of C57BL/6 mice
暴露多环芳烃对小鼠肝毒性及脂质代谢的影响
发表时间:2020.01
期刊:Environ Int
IF:7.577

多环芳烃(PAHs)通常在有机物质的不完全燃烧、热解和释放过程中产生,并富含在颗粒物、香烟烟雾和烹饪油烟。吸入是普通人群暴露多环芳烃的常见途径,会造成多种不良健康影响,包括癌症、突变、免疫系统紊乱以及生殖、发育和心肺损伤。由于多环芳烃的亲脂性,它们在肺、肝和脑等不同器官中有很高的滞留率和较低的清除率。到目前为止,大多数研究人员对吸入多环芳烃的呼吸毒性关注较多,对肝脏的毒性尚不清楚。



1、脂肪在组织切片中的变化和分布
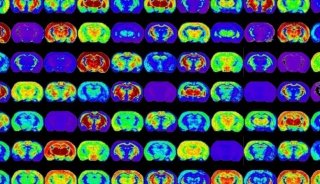
用MALDI-IMS方法对肝脏切片中的脂质进行分析,以评估B[α]P暴露引起的肝脏脂质的空间分布和相对丰度的变化。检测到的化合物在对照组小鼠肝脏切片中的丰度和空间分布不同。

对照小鼠肝脏切片中部分化合物的MALDI-MS成像
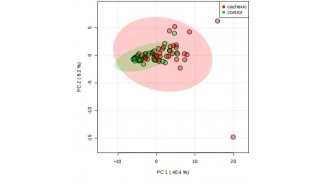
主成分分析结果显示,暴露组与对照组明显不同,说明吸入B[α]P可引起小鼠肝脏脂质代谢紊乱。进行ROC和T检验分析,鉴定出16种可区分对照组和暴露组的脂质,包括6种LysoPC、7种PC和3种SMS。这些脂质在给予B[α]P后丰度增加。一些脂质如LysoPC 22:0、LysoPC 20:5和PC 36:5在B[α]P暴露小鼠肝脏切片中的空间分布也发生了改变。这些结果表明,B[α]P的肝脏毒性导致脂质代谢紊乱,改变了肝脏脂质种类的丰度和空间分布。

肝组织脂质分布
2、肝组织脂质谱的变化
基于LC-MS共检测和鉴定了375种脂质,包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、溶血磷脂酰乙醇胺(LysoPE)、磷脂酰肌醇(PI)、溶血磷脂酰肌醇(LysoPI)、磷脂酰甘油(PG)、磷脂酰丝氨酸(PS)、溶血磷脂酰丝氨酸(LPS)、磷脂酸(PA)、溶血磷脂酸(LPA)、甘油三脂、甘油二脂、单甘油脂、鞘磷脂、神经酰胺、游离脂肪酸、类花生酸。B[α]P暴露后,肝脏脂质类丰度发生明显变化,结果表明,B[α]P暴露可引起大鼠甘油酯、甘油磷脂和脂肪酸代谢异常。
PLS-DA分析显示了B[α]P处理和未处理的样本之间明显区分(图3),进一步验证了暴露于B[α]P引起了显著的肝脏脂质代谢紊乱。根据FC>2.0、FDR<0.05、VIP>1.5和AUC值>0.70筛选出16种不同的脂类,包括PI(16:0/22:6)、PI(18:1/20:4)、PI(18:1/18:3)、PI(17:0/20:4)、PI(18:0/22:6)、PI(18:0/22:5)、PI(19:0/20:4)、PI(16:0/18:2)、PI(18:0/20:4)、PE(18:0)、PE(18:0/22:4)、PE(P-18:0/20:3)、PC(O-16:0/20:4)、PC(O-20:0/20:4)、PE(P-16:0/22:4)和PG(18:0/18:1)。它们可能被认为是暴露于B[α]P的潜在生物标志物。B[α]P暴露上调了小鼠肝脏中的PI,但下调了其他脂质。此外,B[α]P暴露后第7天肝PC的变化趋势与MALDI-IMS平台的变化趋势一致,但B[α]P暴露仅对LysoPC 18:2、PC 34:1和PC 40:7有显著影响。

暴露组小鼠和对照组小鼠肝脏脂质的PLS-DA得分图
3、肝组织中有害脂类的变化规律
卵磷脂、甘油磷脂、鞘脂和类花生酸的生物合成网络在动物中是存在的并且是必不可少的,这些脂质通过不同的反应紧密地联系在一起。

B[α]P暴露对小鼠肝组织脂质代谢网络的影响
甘油三酯是对B[α]P暴露最敏感的脂类,第一天迅速升高。TG前体DG、MG和FFA在暴露第1天仅略有下降,表明B[α]P暴露对肝脏TG的生物合成无明显促进作用,并存在其他来源的TG。
B[α]P暴露可上调肝脏中PC的主要种类,这些PC含有二十二碳六烯酸(DHA,FA 22:6)脂肪酰链,表明B[α]P通过磷脂酰乙醇胺甲基转移酶(PEMT)途径加速PC的合成。除B[α]P暴露第3天外,PEs均降低,其前体PS无明显变化,表明通过CDP-乙醇胺途径合成PEs不能抵消其转化。PI在B[α]P暴露后持续升高,在第7天达到最高水平。由于其上下游产物变化不大,PI升高也可能归因于肝脏外摄取。
吸入B[α]P可降低小鼠肝脏中花生四烯酸(AA)和DHA的含量,升高EPA的含量。B[α]P暴露后,CYP450衍生的二羟基代谢产物AA和DHA分别下调和上调。B[α]P还影响脂氧合酶衍生产物的水平,降低AA、DHA和EPA的羟基代谢产物水平,增加LA的羟基代谢产物水平。

B[α]P暴露后肝脏中个别脂质类随时间的变化
4、肝组织中暴露的时间依赖性效应
暴露后5个时间点样本的PLS-DA计分图彼此明显分开,表明在整个B[α]P暴露过程中发生了明显的脂质代谢失调。总体而言,在5个暴露时间点,46种血脂有显著差异。这些脂质由PE、LysoPEs、PC、LysoPC、PI、LysoPI、DGs和二十烷基类化合物组成。聚类图显示出三条不同变化趋势轨迹。A组以PES为主,第1天后急剧下降,第21天略有上调;B组PC和LPCS聚集,第7天后迅速增加;C组PI在第3天后缓慢上升。第21天这些差异脂质略有恢复,表明肝脏受到扰动后发生了脂质代谢的自我修复调节。

B[α]P暴露不同天数小鼠肝脏脂质谱PLS-DA得分图

环境剂量相关的B[α]P暴露改变了C57BL/6小鼠肝脏中脂质的水平和空间分布,并对甘油脂、甘油磷脂和脂肪酸代谢的扰动起重要作用。B[α]P暴露所致的肝脂代谢紊乱呈时间依赖性。TGS、PIs、PC、PES和二十烷类化合物的改变可能与B[α]P加速血液摄取或肝组织生物合成和转化有关,并可能导致NAFLD、肝细胞膜损伤、炎症和信号系统紊乱。
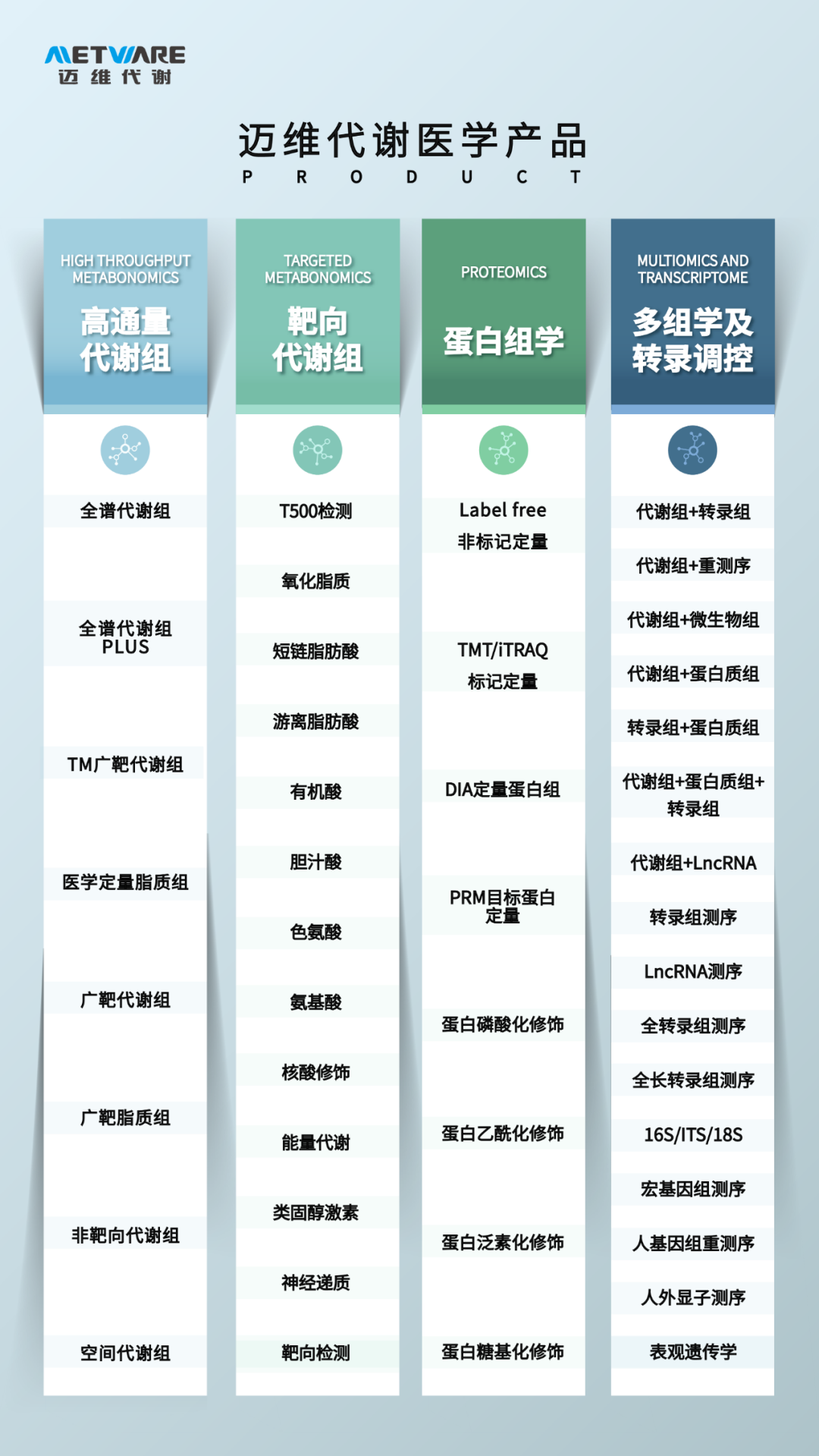
99%的代谢组学研究者都在阅读下文:
●项目文章 | IF=22!新冠患者肠道微生物功能受损的后遗症研究
●重磅综述 | 如何完善微生物组与疾病之间的证据链?从相关性到因果关系的5个层次

客服微信:18062045271
咨询电话:027-62433042
邮箱:support@metware.cn
网址:www.metware.cn
我就知道你“在看”