多组学的力量 | 药物开发中的多组学方法(下篇)
从靶点发现到临床试验再到药物再利用,NGS 和芯片为解释遗传易感性、克隆异质性和耐药在整个药物开发周期中的作用提供了全面的解决方案。NGS 方法可以生成药物开发所必需的多层次组学数据,包括基因组修饰、转录组图谱分析和定量、DNA 和组蛋白水平的表观遗传修饰、蛋白质定量以及微生物组在耐药性中的作用分析(图1)1。
在上周的推送里,我们分享了多组学在靶点发现及验证的应用。
☟☟☟
这周,我们将为大家带来多组学在先导化合物识别、临床前研究和临床试验中的应用实例。

图1:多组学在药物开发中的潜力-NGS和基于芯片的方法使全基因组、外显子组、转录组、表观基因组和蛋白质组的联合分析贯穿于可能提高疗效的新药的整个开发过程。
先导物的识别与优化
筛选经过验证的靶点以识别具有预期生物/ 药理活性的先导化合物,这些化合物是药物设计的起点,能够提高药效学和药代动力学特性。先导物优化的主要目的是增加选择性、提高活性和减少候选药物的副作用。优化候选先导物的ADME(吸收、分布、代谢和排泄) 特性是药物开发阶段的重点。在整个设计过程中,通过多组学分析对先导物进行评估,以识别和表征临床前研究的候选药物(图2)。

图2:先导物的识别与筛选一通过筛选经过验证的靶点,识别先导化合物,然后进行多轮化学修饰和优化。在多组学研究中,使用基于NGS的方法表征正在开发的先导物的特性。
应用实例
分析ADME 基因的甲基化状态
科学家们开发了一种定制的甲基化测序富集panel,覆盖174 个ADME 基因的编码区和调控区。通过测序获得的甲基化模式数据使用甲基化芯片进行确认和验证2。聚焦于这些ADME 基因的甲基化数据可以用来更好地了解药物代谢的基因调控,解释药物反应的差异,或应用于候选先导物的优化过程。
基因表达图谱可为先导物优化提供信息
一家全球性制药公司的科学家们在四种疾病领域考虑了八个不同的药物发现计划。他们评估了基因表达图谱作为开发过程中先导物优化阶段作出决策的工具的有效性。转录组学数据分析揭示了表明正在筛选和优化的化合物具有脱靶效应的生物学相关信号3。
临床前研究
在临床前研究阶段,将在模型系统(细胞系、类器官、患者样本和动物疾病模型)中评估经过验证的候选药物的安全性和有效性(图3)。基于NGS的方法在多组学(包括转录组学、表观基因组学和蛋白质组学)的毒理学研究中表征候选药物治疗的表型效应。

图3:临床前研究-在进行人体临床试验之前,使用体外和体内系统对候选药物的安全性和有效性进行评估。使用基于NGS的多组学方法表征药物疗效。
应用实例
使用组织移植建立小鼠模型用于癌症治疗研究
由于观察到缺乏真正的肾细胞癌(RCC)临床前模型,科学家们通过将组织切片移植物植入小鼠的肾包膜下,建立了一种改进的肿瘤移植模型4。测序和基因表达分析发现,这种RCC 小鼠模型再现了在人类患者中观察到的疾病,使其成为临床前研究和药物开发的理想模型。
临床试验
虽然使用模型系统的临床前研究可以获得重要见解,但是药物开发的最后阶段是通过设计和实施临床试验来评估药物如何与人体相互作用(图4)。这些研究通常从早期的小规模研究开始,发展到后期的大规模研究。临床试验最终确定一种新药对患者是否安全, 是否能有效治疗某种疾病。临床试验的结果由相关监管机构审查,如美国食品和药物管理局(FDA),以获得新药上市的最终批准。除了在正向转化工作流程中评估药物有效性和安全性外,基于NGS 的多组学方法还可用于分析接受现有疗法治疗的患者样本,以在反向转化研究中识别新的靶点和生物标志物(图4)。
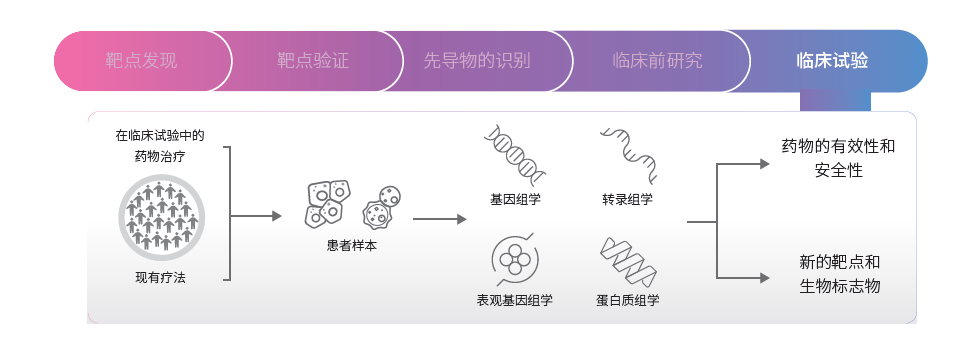
图4:临床试验一在药物开发的最后阶段,开展人体临床试验对候选药物的安全性和有效性进行评估。使用基于NGS的多组学方法表征新药的疗效(正向转化)。对于现有的治疗方法,可以通过多组学方法分析患者样本,以识别新的靶点和生物标志物(反向转化)。
为患者分层提供参考信息
基于NGS 的多组学方法可在研究设计中用于分析患者的分子图谱。可以根据预后或预测标志物对参与者进行选择并分层进行靶向临床试验,这比非靶向临床试验更有效,能获得更多信息7。此外,通过选择可能对特定给药方案有反应的具有某种基因型的参与者, 可以提高固定样本量试验的力量。基于多组学的靶向临床试验的实例包括“伞式”试验、“篮式”试验和混合试验(图5)8:
伞式试验评估多种药物对同 —疾病中多种基因突变的疗效
篮式试验评估单 —药物对多种疾病类型中特定突变的疗效
混合试验将伞式试验和篮式试验设计整合为一个方案

图5:NGS指导的用于临床试验的患者分层-在靶向临床试验中,使用多组学方法对潜在参与者进行分子图谱分析,然后针对不同的试验类型进行分层和选择。
应用实例
基于RNA-Seq 数据对癌症患者进行分层研究
科学家使用RNA-Seq 开发了一种新的基因表达特征,能够将急性髓细胞白血病(AML)患者分为不同的风险组。RNA-Seq 数据还识别出一组患者,他们具有可导致整合素信号失调的变异,局灶性粘附激酶抑制剂可能对其有效5。
RNA-Seq 可以对自身免疫性疾病患者进行分层
科学家们使用机器学习方法分析RNA-Seq 数据,并对系统性红斑狼疮(SLE)患者进行分层。将患者分为不同的组, 发现了与表型差异相关的特定基因表达特征。这种方法可以增加对疾病异质性的了解,改善临床试验设计6。
总结
新药开发对改善医疗护理至关重要,但其成功率低,需要投入大量的时间、资金和资源。将基于NGS 的方法整合到药物开发工作流程中可以提高成功率,并增进对多种因素的理解,包括药物的作用机制、患者特异性疗效和毒性等。Illumina 提供了端到端NGS 和芯片解决方案的创新产品组合,可以为从靶点发现到临床试验和药物再利用的药物开发周期提供支持。