高温液相色谱(HT-LC )在医药领域中的应用:挑战和成就
摘要:在药厂中,建立适合于评价药物活性成分(APIs)和配方药效/ 纯度的分析方法是其分析部门的主要工作。为了识别潜在的杂质,药物实验室采用的分析方法通常是比较缓慢的。然而,对于许多分析如研发、药物代谢、化学过程研究,这些方法都是太慢而不合实际。一种提高液相色谱分析速度的方法是提高温度,本文讨论了升高温度的优势,包括灵敏度改善,选择性变化,以及采用温度梯度同时分析极性和非极性分析物。高温色谱具有许多优点,随着仪器性能的改善,这些方法将具有很好的重现性且能用于论证分析。
Abstract:The development of appropriate potency/purity methods for the evaluation of active pharmaceutical ingredients and formulations is a major concern for the analytical departments in the pharmaceutical industry. Many of the traditional LC methods used in pharmaceutical laboratories are slow runs designed to identify any possible impurities. However, for many applications, such as support for colleagues in discovery,metabolite studies, and process research, these methods are too slow to be practical. One way to speed up an LC run is to increase the temperature, and this article discusses the benefits of elevated temperatures, including sensitivity improvements, selectivity changes and simultaneous analysis of polar and nonpolar analytics using temperature gradients. The conclusion is the HT-LC offers many advantages, and the advances in instrumentation allow these methods to be highly reproducible and capable of validation.
1 前言
在药厂中,发展适合于评价药物活性成分(APIs)和配方药效/ 纯度的分析方法是其分析实验室的主要工作。许多研究人员通常根据经验来建立相对稳定的液相色谱方法,这些方法也可能用于未来的临床药物检测。研究人员希望采用这些方法将一些药物生产过程中可能产生的杂质及潜在的降解产物与药物活性成分分开。大多数的降解产物和杂质通常具有和药物活性成分相似的结构,分析方法对于选择性的要求具有相当的挑战性。方法发展过程中为了确保所有的峰都能得到分离,常需要采用具有更强保留能力的较长色谱柱和较缓的流动相梯度来分析可能的降解产物。实际上,人们更希望建立等度的药物活性成分的液相色谱分离方法,以减少方法在移植过程所带来的重现性问题。通常的方法是采用150 mm × 4.6 mm 的色谱柱(5μm 或3μm 的填料粒径),在45 min 内完成分析任务。
可靠的分析方法能够满足临床药物稳定性评价或质量评价的需求。然而,当需要将杂质分离以便进一步识别时,这些方法的分析时间对于研发(毒性材料的纯度评价)、药物代谢(代谢产物的评价)、化学过程研究(纯度评价用于改进合成过程)、药物研究(赋形剂的兼容及配方开发)甚至是对于一般的实验室分析而言都太长,甚至不合实际。分析时间取决于样品对分析系统的适应性,这也将给那些等待分析验证方法提供数据的部门很难做出决定。因此,探索不增加成本,且能在不损失峰容量和分辨率的条件下提高分析通量的方法具有非常重要的意义。
液相色谱分析中提高柱温(>40 ℃)的优点已有诸多报道[1,2]。随着温度的升高,流动相的粘度将会降低,从而可以采用更高的流量(甚至可以高达8 mL/min)以达到高通量的分析。同时,由于流动相粘度的降低, 更细粒径的填料(<3 μm)以及更长的色谱柱甚至多根色谱柱的耦联可以被采用,从而使得一些很难分开的关键色谱峰能够得到基线分离。此外,由于分析物在高温下快速通过色谱柱,分析物的扩散也会得到改善,区带展宽变小,柱效增加。系统温度的升高也会改变水的介电常数,使得水具有有机溶剂的特征。方法发展中有机溶剂使用的减少,使分析成本降低,为液相色谱提供了一种“绿色”的流动相。由于当前仪器条件的限制,有机溶剂梯度尚不能完全被温度梯度所取代[3-5]。
尽管几年前高温液相色谱的优点就已经得到认可,然而直到最近,商品化的仪器才克服了一些技术上的问题。在样品进入色谱柱前,对流动相进行预热可以解决温度不匹配的问题;而在进入检测器前,对色谱柱洗脱下来的产物进行快速冷却可以解决检测问题,将具有蒸气传感器的自动开关阀嵌入到商品化的柱温箱中可以解决有机溶剂过热所带来的安全问题。值得注意的是,温度不匹配问题的解决可以将色谱柱的柱效提高50% 以上。最近色谱柱技术的进步也为温度可达到200 ℃以上的方法提供了稳定的色谱柱选择。这些色谱柱包括氧化锆、多孔石墨碳、预保护的多配位基硅胶和二乙烯基苯基质的色谱柱[2]。
2 在药物实验室的应用
2.1 用于纯度评价的快速液相色谱方法
以作者的经验,对于一个评价纯度的分析方法,平均需要45 min 的分析时间。在进行样品分析之前,还需要进行其他实验,包括溶剂空白的分析、样品的适应性、定量限等;每个实验通常也至少需要进行5 次以确保定量结果。就这个时间范围而言,一组样品的分析至少需要3.5 h 的分析时间。而对于评价一个样品的纯度所需要的时间将长达6.5 h。
这个时间范围只有少数的实验可以接受,那些需要更快循环周期的研发部门在进行分析之前将可能采用其他的方法,包括采用一些没有验证的梯度方法或者不评价空白或系统适用性。采用这些替代方法有可能会出现一些问题,包括由于杂质和药物活性成分的共洗脱而造成的潜在杂质的丢失,系统不能达到足够的检测限,潜在的杂质在死时间下被洗脱,潜在杂质的定量结果不重现,以及与空白有关的峰定量等。高温液相色谱(HT-LC)能够加快这些评价纯度方法的论证而不损失分辨率与选择性。
图1 给出的序列图是一种显影混合物中光敏感成分的色谱图,这种方法被第十次国际标准化会议推荐作为光稳定研究的标准分析方法。采用Zorbax C18 柱(75 mm × 4.6 mm)(Agilent Technologies, New Castle, DE)进行分析。流动相为水和乙腈,添加剂为0.01%TFA,采用70/30(v/v)的流动相等度分离20 min,然后在10 min内梯度变化至20/80(v/v)。
图1a 给出的是30 ℃下的色谱分离图。方法采用较常用的150 mm × 4.6 mm 色谱柱(5 μm填料)。当将色谱柱的柱长减少一半、粒径也降至3.5 μm 时,可获得相似的选择性而分析时间缩短一半。峰A 和峰B(API)的分离度为9.7。峰C 是两个部分重叠的组分。图1b 是温度升至60℃的结果。API (峰B)的保留时间缩短.5min,而API 和峰A 的分离度(9.3)没有改变;峰C 中的两个组分在这一条件下完全重叠。图1c是90 ℃下的色谱分离图。峰A和峰B的峰高和总柱效显著增加。但这些峰的分离度为7.6。选择性仍然没有改变,所有的峰都在等度区域中被洗脱。图1d 仍然是温度为90 ℃下的色谱图,但有机溶剂梯度从7 min 开始而不是如前所述的20 min。峰C 中两个成分的分辨率和30 ℃下相同。色谱柱在所有温度范围内均具有很好的重现性和稳定性。所有的色谱峰都能在30 ℃条件下得到检测,在90 ℃下也能得到检测且选择性相似,柱效也有所提高,同时色谱峰变窄(这一点很重要,因为在高温下色谱峰被显著地压缩),峰容量提高,从而可以检测出以前没有被检测出的色谱峰。
表1 总结了在120 ℃下API 纯度分析实验所得到的数据和结果。在120 ℃下获得的数据是有限的,因为这个温度刚好是聚醚醚酮(PEEK)材料的耐受极限。整个方法的运行时间从50 min降至20 min。这样,一个样品的纯度分析可以在2.5h 内完成,包括系统适应性评价。除了改变温度和有机溶剂梯度,不改变其他色谱参数而加快分析速度非常有意义。采用更长的色谱柱可以增加样品在柱上的保留时间,而采用更细的填料在高流量下能够得到更高的柱效和更好的分辨率。
在高温液相色谱分析中分析物的稳定性是一个主要问题。然而,到目前为止,以作者的经验,还没有遇到此类问题。对于热不稳定的化合物,采用高流量可以减少或消除稳定性的影响,因为这可以减少分析物在柱温箱中的停留时间[4,6]。
2.2 改善灵敏度用于低含量杂质的测定
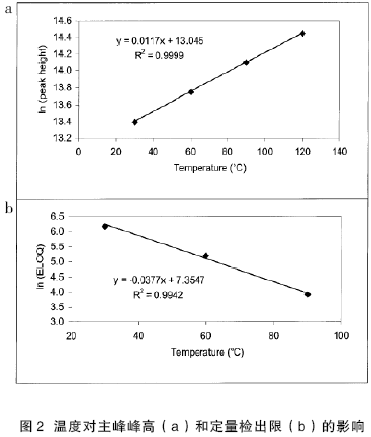
正如我们所讨论的,升高温度可以加快分析物在流动相和固定相之间的传质速率,而传质速率的增加将会明显降低分析物的纵向扩散。因此,我们可以看到峰高明显增加而峰宽减小。这也是我们在前面部分中讨论的高通量纯度分析方法的结果,如表1 所示。如果以表1中主峰峰高的自然对数对温度作图,可以得到一条直线(如图2ab 所示)。图2b 是一种药物活性成分中的潜在杂质(卤化烷烃)定量限的自然对数随温度变化的曲线,从图2b中可看出,当峰高呈指数增加时,灵敏度也呈指数增加。从0.09 至1 ppm(浓度为200 ppm 目标分析物的0.05 或0.5%)作低含量组分的线性曲线,线性关系显示,对于特定的分析物,随着分析温度从30℃升至90℃,定量限可降低至原定量限的十分之一。灵敏度的提高对于开发部门控制和监测低含量有毒的潜在杂质及降解产物非常有利。相比那些采用昂贵的检测系统(如LC-MS/MS)进行此类分析的方法,配备常规紫外检测器的高温液相色谱更经济合理。
2.4 利用选择性的变化提高分离度
范霍夫方程指出,对于某一特定的分析物,其保留时间取决于与分析物在流动相和固定相之间的传质有关的热力学因素(ΔHo),这也意味着某一分析物或某一类分析物的保留时间随温度变化的程度很难预测(如图3)。以75 mm× 4.6 mm 的Zorbax SB-C8 柱(3 μm)为分离柱,以0.5% 甲酸/ 乙腈(72/28,v/v)为流动相等
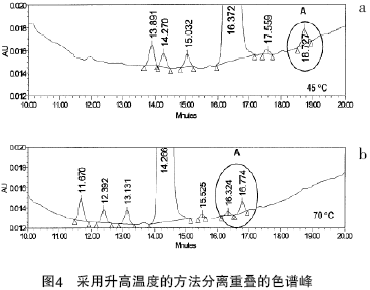
度分离这些药物活性成分(和各种在合成过程中产生的杂质)。所有组分的保留时间随着分析温度的升高而减少。与峰B 相比,峰A 和峰C受温度的影响更加明显。因此,峰B 和峰C 的洗脱顺序完全颠倒。这种选择性改变的特征在混合组分的分离中非常有用,因为它只需升高温度,而无需改变其他的色谱条件。高温下柱效的提高将有利于得到预想的分辨率。例如,图4a 是一种药物活性成分中痕量组分的色谱分离图,采用C18 柱为分离柱,以0.01%TFA 和乙腈为流动相在45 ℃下进行分离。质谱推断峰A 的结构时,发现有两个组分被同时洗脱。分离方法不变,将温度从45 ℃升至70 ℃,两种成分可得到基线分离(见图4b )。将馏分收集下来进一步采用质谱和峰面积百分比分析,证实了两种组分的存在。
2.5 采用温度梯度同时分析极性和非极性化合物
进行快速的温度梯度分析是近年来仪器的重要进展之一。采用现代的预热器,流动相可以在25~200℃之间均一重现地以约20℃/min 的速度被加热。柱后冷却单元可以避免温度改变引起的检测器波动,通常是将洗脱产物的温度调整到一个固定值(如35℃)。因为水的极性随着温度的升高而降低,采用温度梯度替代有机溶剂梯度的
可能性已有报道,但前者比后者对分离的影响要弱,因此还不能被普遍采用,但是这一特性仍非常重要。据报道[1,2],有机溶剂(乙腈和甲醇等)含量变化1% 和柱温变化3~5 ℃时的洗脱效果相同。这些报道提出可以采用等度(100% 的水溶液流动相)分离低分子质量的化合物,例如可可粉成分和镇静剂或者低聚物和肽[2-5,7]。
与等温下的高温分析相比,采用程序升温对色谱柱的要求更为苛刻。即使在低于120℃的温度下,氧化锆基质的色谱柱在温度梯度条件下固定相也会逐渐流失。不仅作者的实验室观察到了这个现象,其他的实验室也有类似的报道[8]。实际上,色谱柱的选择是一个很大的障碍,特别是在医药分析领域。在进行医药分析时待分析物通常都比较大,亲脂性强,杂质与活性成分具有相似的结构。许多分离方法都是采用高有机溶剂作为流动相来确保分析物被洗脱下来,同时采用有机改性剂避免峰拖尾,以达到预想的分离度。因此,以作者的经验,至少在以稳定性为特征的纯度分析中采用100% 的水溶液流动相或者完全消除有机溶剂是不可能的。随着柱技术的进步,这些局限将会得到解决,温度梯度液相色谱将会成为一种快速的分析方法,特别是针对前期的开发部门。此外,温度梯度也能应用于其他方面。
与等温下的高温分析相比,采用程序升温对色谱柱的要求更为苛刻。即使在低于120℃的温度下,氧化锆基质的色谱柱在温度梯度条件下固定相也会逐渐流失。不仅作者的实验室观察到了这个现象,其他的实验室也有类似的报道[8]。实际上,色谱柱的选择是一个很大的障碍,特别是在医药分析领域。在进行医药分析时待分析物通常都比较大,亲脂性强,杂质与活性成分具有相似的结构。许多分离方法都是采用高有机溶剂作为流动相来确保分析物被洗脱下来,同时采用有机改性剂避免峰拖尾,以达到预想的分离度。因此,以作者的经验,至少在以稳定性为特征的纯度分析中采用100% 的水溶液流动相或者完全消除有机溶剂是不可能的。随着柱技术的进步,这些局限将会得到解决,温度梯度液相色谱将会成为一种快速的分析方法,特别是针对前期的开发部门。此外,温度梯度也能应用于其他方面。
3 结论
在药物分析中发展高温液相色谱法非常有益。它有可能成为一种快速高选择性的纯度分析方法。由于采用了更高的温度,因此可以获得更高的柱效,从而使方法灵敏度得到改善。仪器方面的发展也使这种方法具有较好的重现性。色谱柱改进将使这种技术可能应用于常规实验。
参考文献
-
Greibrokk, T. ; Andersen, T. High-temperature liquid chromatography. J. Chromatogr. A 2003,1000(1), 743-55.
-
Zhu, C. ; Goodall, D.M. ; Wren, S.A.C. Elevated temperature HPLC: principles and applications to small molecules and biomolecules. LC?GC North Amer. 2005, 23(1), 54-72.
-
Clark, J. Using high temperature HPLC for improved analysis. Pharm. Tech. Eur. 2004, 16 (5),41-6.
-
Clark, J. Temperature-programmed HPLC.Today’s Chemist at Work 2004, 13(8),43-5.
-
Sanagi, M.M. ; See, H.H.; Ibrahim, W.A.W. ;Naim, A.A. High temperature liquid hromatography of triazole fungicides on polybutadienecoated zirconia stationary phase. J. Chromatogr.A 2004, 1059(1), 95-101.
-
Thompson, J.D. ; Carr, P.W. A study of the critical criteria for analyte stability in high-temperature liquid chromatography. Anal. Chem. 2002,74(5), 1017-23.
-
Yang, X. ; Ma, L. ; Carr, P.W. High temperature fast chromatography of proteins using a silica-based stationary phase with greatly enhanced low pH stability. J. Chromatogr. A 2005,1079(1),213-20.
-
Marin, S.J. ; Jones, B.A. ; Felix, W.D. ; Clark,J. Effect of high-temperature on high-performance
liquid chromatography column stability and performance under temperature-programmed conditions. J. Chromatogr. A 2004,1030(1), 255-62.
相关阅读:
- 用液相色谱-正离子模式电喷雾质谱分析22种原水和净化水中碱性和中性农药及其代谢物 (UUBird, 2008-6-09)
- 英国癌症研究院将首次与药厂共同开发抗癌新药 (laurie_dly, 2008-6-10)
- 滥用药物的LC/MS监测 (UUBird, 2008-6-11)
- LC/MS/MS法定量分析全氟辛酸 (UUBird, 2008-6-11)
- 世界分子量最小的凝集素 或将成为药物靶向输送载体 (laurie_dly, 2008-6-13)
- 用1.8 μm反相(RP)色谱柱进行快速氨基酸分析(AAA) (UUBird, 2008-6-16)
- 固定化金属离子亲和色谱用于蛋白质及肽的分离分析 (UUBird, 2008-6-16)
- RTL和3路分流器在草莓提取液分析中的应用 (UUBird, 2008-6-16)
- 通过减少延迟体积轻松进行高通量分析的梯度优化 (UUBird, 2008-6-16)
- 用Eclipse Plus C18柱分析磺胺药物 (UUBird, 2008-6-17)