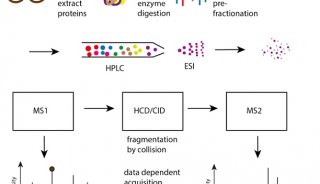
蛋白质染色
二维凝胶电泳(2-DE)是广为蛋白质组学科学家们应用的经典技术之一,蛋白混合物在两个维度上被分离。第一步是常规的等电聚焦,此过程中蛋白质根据其等电点被分离。接着,第二维使用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白质按分子量进一步分离。上述两步操作在互相垂直的两个方向上,使分离的蛋白可以铺满整块凝胶板。
分离只是一部分。分离后的蛋白需要在凝胶上显色,才能用于后续的定量研究,或从凝胶上取出用于鉴定。一些情况下,倾向于用银染或考马斯亮蓝染色胶上的蛋白,然后测定蛋白点显色的强度。另外,荧光染色法也十分普遍。各种染色法的灵敏度不同,在实践中选用何种染色法,要考虑它们的成本。
另一类显色技术是在2-DE分离前对蛋白质进行处理。与上述染色技术不同,这项处理要求发生一种化学反应,以确保蛋白质和试剂在电泳过程中结合在一起。这种技术可使用许多种荧光标记试剂。常用的基于青色素的CyDyes染料是包含三种染料的一套系列,这三种染料发色不同,因此可以比较不同条件下的蛋白(如疾病和健康的样本)。
日前,来自三个国家的科学家在一项“五中心研究”中对一套新的商用的标记染料进行了评估。赫尔曼·约瑟夫·蒂尔泽(Hermann-Josef Thierse)和来自海德尔堡大学、弗莱堡、萨拉戈萨、犹他州及位于海德尔堡的德国癌症研究中心的同事们共同进行了三种马来酰亚胺染料的相关研究,研究发现,与CyDyes染料类似,这些马来酰亚胺染料与蛋白质的半胱氨酸的巯基反应,能生成荧光衍生物。
生成的荧光衍生物为发射波长为530nm的蓝色染料Dy-505-MAL、发射波长为572nm的绿色染料Dy-555-MAL,以及发射波长为671nm的红色染料Dy-635-MAL。在最初的实验中,这些荧光衍生物均与人体血清白蛋白(HAS)发生了反应,蛋白再用SDS-PAGE分离。
检测结果中,每一个标记的蛋白质均会产生清晰的发射光谱,但存在的问题是在检测Dy-505-MAL时,Dy-555-MAL会出现重叠信号。Dy-555-MAL标记的蛋白也是三个被标记的蛋白质中仅有的一个会在凝胶上产生拖尾/条纹的,因此,在进一步实验中将这一染料排除。
利用剩下的两个染料,标记的HSA的荧光发射得到了很好的发射强度-蛋白质浓度线性关系图,便于进行定量研究。而且它们具有很高的灵敏度,检测限为0.13n gHSA,这与CyDyes的效果大致类似,且优于从通常的Flamingo染色点得到的1 ng检测限,线性范围可以扩展超过3~4个数量级。
用该染料标记在用接触性过敏原镍处理或自然生长的人角质细胞中培养出来的蛋白,得到了比Flamingo染色法更高的凝胶图像质量,且可以在每块凝胶中检测出1000多个斑点,检测数量增加了三倍。
利用以上两种染料,鉴定出1584个蛋白点,并且在标记样本之间找到了677个准确的匹配。进一步的分析,有534个蛋白点专一结合DY-505-MAL,373个专一结合DY-635-MAL。因此,当综合两块胶的结果时,只有43% (677/1584)的蛋白质匹配;不匹配暂时认为是由于标记后改变了蛋白质的迁移特性造成的。
结论是,不同的蛋白质组学分析方法在使用2D凝胶时受到了限制。然而,研究者表示这两种染料仍适合于使用单染料的凝胶-凝胶实验,这与角质细胞证实的结果相同。对受控的和镍处理的细胞的凝胶电泳结果进行对比分析,结果显示染色点高度一致,其中80%未受镍影响,11%下调控,9%上调控。
由于标记的蛋白质可以使用质谱分析,所以随后的蛋白质鉴定用通常的方法也可以进行。
2D凝胶电泳差谱法中标记染料的局限性或许对一些用户产生了障碍,但不失为一种替代性方法。其它在DY范围内的染料或许会提供更多一致的迁移特征。
上述标记法的成本大约比CyDye饱和标记套装低50倍,因此成本可能是促使用户选择的一个因素。但最重要的是,这种方法会提高蛋白的覆盖率、灵敏度和染色点质量,这些均会吸引研究者的注意,同时也会节约研究者的时间。
-
精英视角

-
综述
-
焦点事件