肿瘤靶向药物成像的未来发展 -- PI与MALDI成像相结合
摘要
在过去的十年中,人们从研究植物代谢组学到发现疾病的生物标志物研究,再到开发新的疗法,基质辅助激光解吸电离(MALDI)成像技术已成为这些研究中不可或缺的工具。MALDI 技术通过提供对治疗化合物及其代谢物的直接分布监控以及非靶向药效学信息,革新了临床前药物开发流程。
目前,MALDI 成像的一个重要应用是肿瘤学的组织分析,同时MALDI技术的最新发展有望为癌症研究带来更大的好处。MALDI 与激光诱导电离(PI)的组合可增强药物化合物和其他化合物的检测和成像,使得 MALDI 成像在研究肿瘤组织中药物代谢和药效学方面取得了重大进展。
本文介绍了 MALDI 成像技术在肿瘤学应用中的价值,并探讨了 PI 技术的发展潜力,包括实现高至三个数量级的更高灵敏度,且使用传统 MALDI 无法检测到代谢产物成像分析。
MALDI 技术起源于1980年代后期,其最早设计目的是作为质谱(MS)电离方法(1)。后来在1994年被发展成为一种成像技术,可绘制包括从小分子代谢物到没有标签或标记的大分子蛋白(2)的稀薄切片样品中分子的分布图。随后,Richard Caprioli 和他的同事(3)将这种方法扩展到组织切片分析中。他们开创性的研究表明,MALDI-MS 可将细胞和组织中的大型生物分子(例如蛋白质和脂质)可视化,进而揭示这些分子以及癌症等疾病如何改变分布。
在过去的二十年中,随着技术和方法学的进步,不断提高的分析通量和空间分辨率大幅提高了 MALDI 的成像性能。这些发展推动了 MALDI 在肿瘤学、神经病学、心脏病学和风湿病学等生物医学研究领域应用中的接受程度。在基于组织的成像研究中,人们首次使用 MALDI-MS 分析组织中的蛋白空间分布,并且提供有关单个蛋白质、蛋白质变体和翻译后修饰(PTM)的分布信息(4)。与传统的免疫组织化学(IHC)实验不同,通过使用MALDI成像技术,研究人员可以同时定位数百种蛋白质。
从那时起,MALDI 成像技术已扩展到传统蛋白质组学之外,成功的用于测量小分子、代谢产物、脂质、聚糖、核酸等。MALDI-MS 优于 IHC 等传统技术的另一个主要优势,是能够对化合物进行成像。通过使用这种非靶向研究,研究人员可以测量以前没有表征过的疾病途径分子特征。
MALDI 肿瘤影像学
将 MALDI 成像用于癌症研究应用的论文已经大量发表。长期以来,该技术一直用于发现和监测潜在治疗化合物及其代谢产物,同时将其用于分析组织蛋白的潜在临床价值,以便实现癌症的早期诊断、预后和预测。传统药物研发中的安全、有效药物发现和开发都是基于血浆中母体药物的检测。但是,血浆中发现的大多数药物靶标都是在发生作用的尾端并被稀释,因此确定并提供母体药物及其代谢产物的相关组织分布,有助于人们更好地了解药理学和毒理学概况。
常规分析方法,例如全身放射自显影(WBA)和液相色谱-质谱(LC-MS),他们虽然提供了一些与组织相关的信息,但又分别受到放射性标记探针和匀浆组织提取物要求的限制,无法提供更全面的信息。MALDI 成像相对于两种方法均具有优势:作为一种无标记技术,MALDI 成像可以将母体药物、代谢物、杂质和降解产物检测为单独的实体,从而生成有关药物化合物和重要代谢物定位的重要信息;与 LC-MS 不同,MALDI 成像可以提供高度局部化的分析物空间信息,在传统的提取和匀浆过程中可能会忽略这些信息。
发现生物标志物
MALDI 成像为新的疾病生物标记发展做出了重要贡献,特别是在癌症研究领域。由于癌细胞和组织的异质性,保持空间完整性变得至关重要,而这种分析非常适合 MALDI 成像。特别是 MALDI 成像已成功检测出癌症中未知的蛋白质,尤其是聚糖生物标志物的发现大幅推进了癌症研究进展。在此类研究中,MALDI 成像已用于表征癌症组织中的 N-连接聚糖分析,同时帮助研究人员开发出肿瘤特异性聚糖生物标记物。
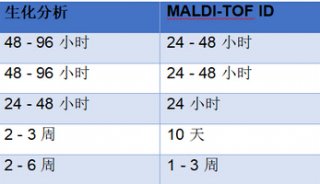
据估计,超过 50% 的人类蛋白质是糖基化的,而糖基化是人类最常见和最复杂的后修饰之一(5)。在病理学水平上,虽然糖基化的变化对肿瘤研究具有重要意义,但人们仍未有效证明它。直到最近,人们将 MALDI 成像技术用于 N-连接的聚糖分析,成功的将糖基化过程在组织中直接定位,同时为不同的聚糖匹配不同的组织特征。例如,在一项对透明细胞肾细胞癌(ccRCC)的研究中(一种通常在晚期阶段对化疗和放疗产生高抵抗力的肾脏癌普遍亚型),MALDI 成像能够识别多种 N-聚糖ccRCC(6)。图1 显示了代表性的 ccRCC 组织中的 N-聚糖谱图,它具有被原纤维囊隔开的肿瘤(Fuhrmann 2级)和非肿瘤切片。用 MALDI 成像评估 N-糖基化和其他聚糖类能帮助临床医生提供新的治疗和诊断测定线索。
图1:生物标记物发现:代表性 ccRCC 组织的 N-聚糖的质谱成像图。通过 MALDI-FT-ICR 成像分析了Furhmann 2级 ccRCC 组织的N-聚糖分布。(a)H&E染色显示特定区域的三个聚糖的重叠图像:原纤维(蓝色;m / z = 2122.7245,Hex5HexNAc4Fuc1NeuAc1),非肿瘤(绿色;m / z = 2523.9088,Hex6HexNAc6Fuc2)和肿瘤(红色;m / z = 2539.9037,Hex7HexNAc6Fuc1)。(b)具有二等分的 GlcNAc 的 N-聚糖和位于非肿瘤区域的多个岩藻糖基化残基。(c)高甘露糖 N-聚糖的分布。根据 CCBY-NC-ND 4.0,从参考文献(6)中复制。
诊断潜力
癌细胞和其他患病组织具有影响基因组表达级联的重要遗传和表观遗传修饰。无论是研究蛋白质组、脂质组还是代谢组,化合物的空间分布都包含重要信息。因为组织水平通信网络是癌症生长必不可少的因素,而空间信息有助于增加上下文线索,因此缺少空间信息的组学生物标志物探索可能会受到限制。MALDI 成像能够识别可用作预测或预后生物标志物,并充当将患者分为合适的治疗组并预测对治疗反应的角色(7)。
肿瘤亚群表征
监测肿瘤的发展对控制和成功治疗癌症起到至关重要的作用。然而,肿瘤的异质性对有效药物的开发以及准确的预后和诊断提出了重大挑战。通过确定不同肿瘤亚群并详细了解局部分子变化对成功治疗起到决定性作用,MALDI 成像逐渐成为表征肿瘤异质性的工具。
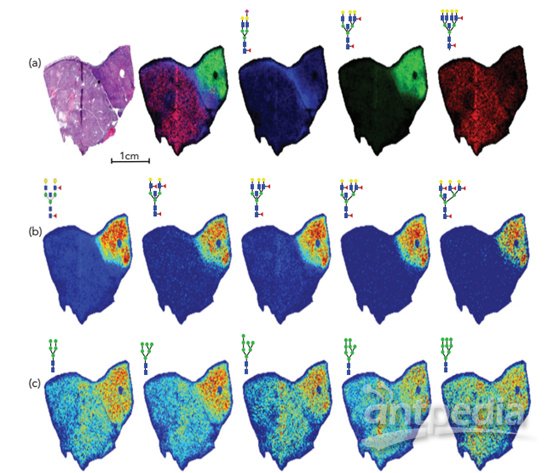
一项研究将脂质的 MALDI 成像与深度蛋白质组覆盖相结合,利用 LC-MS/MS 发现乳腺癌肿瘤亚群的生物标志物和分子特征(8,9)。通过基于激光显微切割(LMD)的微蛋白质组学(timsTOF fleX,Bruker Daltonics)分析肿瘤内异质性,可使用肿瘤切片中的脂质成像来划定感兴趣目标区域(ROI)。在这项研究中,研究人员使用同一组织切片进行成像、染色和基于 LMD 的显微技术分析是有好处的。图像处理后,将肿瘤亚群区域的边界转移到同一连续切片的光学图像中,参考该切片一起扫描的示教标记(图2)。这项研究让 MALDI 成像技术与 LMD 进行配准,进而精确切割感兴趣的区域。
图2:图像处理流程,用于从原始数据中分割生成感兴趣区域(ROI)边界信息,x和y轴作为激光捕获显微切割(LMD)坐标。该工作流程包括平滑、去除小物体、填充孔、边界检测和放大光学图像。
通过对蛋白质的提取和胰酶切的显微微切割后,使用 PASEF 进行蛋白质组学分析。蛋白质组学数据分析为原位细胞类型特异性生物过程提供了全面的机制理解,同时补充了工作流程。
成像技术的发展
MALDI-MS 与离子淌度(IMS)技术的结合,极大地拓宽了 MALDI 分析化合物的范围。IMS 的出现为质谱分析增加了另一个维度。在过去的二十年中,IMS 技术的出现使得人们能够快速分离和分析复杂混合物(例如组织和细胞)中的生物分子。其原因是等质量脂质分子在分析之前,质量相近脂质、肽段和寡核苷酸分子已在流动性细胞中预先分离。IMS 技术有很多种类,但近年来在组织成像方面做出了重大贡献的IMS 技术是捕获离子淌度谱(TIMS)。利用 TIMS 通过迁移率来分离离子,进而提高了灵敏度,同时 CCS 供了其他的可能性。
MALDI-TIMS 成像平台的引入极大地增强了从单个组织切片获得的信息量,提高了全面研究生物过程(如癌症)分子驱动因素的能力。然而,自从发明 MALDI 以来,灵敏度真正的飞跃是增加了激光诱导后电离(PI)技术(10)。这是由明斯特大学研究人员开发的技术。研究表明,这种新方法将许多化合物的成像灵敏度提高一至三个数量级,尤其是在药物代谢和药代动力学(DMPK)研究中,极大地扩充了 MALDI 的应用范围。
通过增强分子信号,激光诱导 PI 不同于传统 MALDI 技术,尤其是对脂质,小分子和许多药物化合物来说,无需离子化。例如,一项研究表明,与传统的 MALDI 分析相比,通过激光诱导的 PI 分析的 70% 以上的药物化合物,其信号强度提高多达两个数量级(11)。灵敏度的提高使药物化合物分布可视化,进一步证明了激光诱导PI成像在药物研发中的潜力。
类固醇
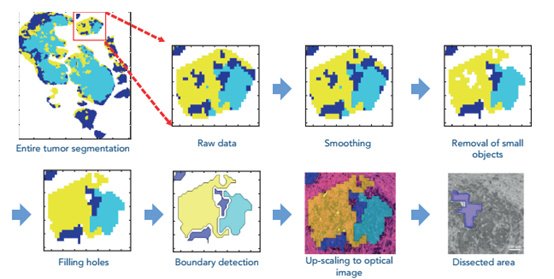
类固醇是在植物、动物和真菌中普遍存在的一类重要的生物化合物。人们对研究类固醇在组织中的分布产生了极大的兴趣。但是直到现在,由于其非极性核心结构,人们在使用 MALDI 分析类固醇化合物时仍不能很好地将其离子化。许多类固醇常用于癌症治疗,或者作为化学疗法的一部分直接缩小肿瘤,或者作为抗炎药或治疗恶心、反胃。图3 显示与传统 MALDI 成像相比,用于癌症治疗的三种关键类固醇的激光诱导PI的灵敏度显著提高(12)。泼尼松龙的灵敏度增加了 100 倍,阿霉素增加了 25 倍,紫杉醇增加了至少 500 倍。
图3:类固醇成像技术的发展有助于提高类固醇的敏感性(a)泼尼松龙,(b)阿霉素和(c)紫杉醇。对于泼尼松龙,将稀释液独立地点到肝匀浆上,然后用激光诱导的电离后(PI)开启和关闭进行成像。对于阿霉素和紫杉醇,将单一稀释液点样在肝匀浆上,然后通过激光诱导的电离后(PI)开启和关闭进行成像。
通过对这些化合物进行成像,研究人员可以更好地了解类固醇在组织中的分布情况,进而改善它们在癌症治疗中的使用方式。
持续创新
激光诱导 PI 引入影像学领域将彻底改变临床研究,同时使临床诊断受益,尤其是肿瘤学领域。激光诱导 PI 已应用于 MALDI-ESI 双离子源质谱仪。结合高质量精度和先进的 MALDI 成像技术,分离和识别复杂混合物中的待测物,如脂类和聚糖(13)。随着这项新技术在未来几年内与最先进的质谱仪相结合的不断发展,这将改变新的癌症生物标志物发现,同时优化治疗方案、预后和诊断。
参考文献
(1) M. Karas, D. Bachmann, and F. Hillenkamp, Anal.Chem. 57(14), 2935–2939 (1985).
(2) B. Spengler, M. Huber t, and R . Kaufmann,“MALDI ion imaging and biological ion imaging with a new scanning UV-laser microprobe,” paper presented at the 42nd American Society for Mass Spectrometry Conference, Chicago, IL, USA, 1994.
(3) R.M. Caprioli, T.B. Farmer, and J.Gile, Anal. Chem. 69(23), 4751– 4760 (1997).
(4) M. Stoeckli, P. Chaurand, D.E.Hallahan, and R.M. Caprioli, Nat. Med. 7, 493–496 (2001).
(5) R.R. Drake, T.W.Powers, E.E. Jones, E. Bruner, A. Mehta, and P.M. Angel, Adv. Cancer Res . 134,85 –116 (2017).
(6) R.R. Drake, C. McDowell, C. West, F. David, T.W. Powers, T.Nowling, E. Bruner, A.S. Mehta, P.M. Angel, L.A. Marlow, H.W. Tun, and J.A.Copland, J. Mass. Spectrom. 55, 44–90 (2020).
(7) A. Ly, M. Aichler, and A.Walch, Hospital Healthcare Europe. https:// hospitalhealthcare.com (accessed2013).
(8) J. Oetjen, R. Hebeler, F. Dewez, C. Henkel, B. Balluff, and R. Heeren,“MALDI guided SpatialOMx uncovers proteomic profiles in tumor subpopulations ofbreast cancer,” Application Note, Bruker Daltonics (2020).
(9) F. Dewez, J.Oetjen, C. Henkel, R. Hebeler, H. Neuweger, E. De Pauw, R.M.A. Heeren, B.Balluff, Proteomics (2020) https://doi.org/10.1002/ pmic.201900369.
(10) J.Soltwisch, H. Kettling, S. Vens-Cappell, M. Wiegelmann, J. Müthing, and K. Dreisewerd, Science 348, 211–215 (2015).
(11) F.P.Y Barré, M.R.L. Paine, B. Flinders, A.J. Trevitt, P.D. Kelly, R. Ait-Belkacem, J.P.Garcia, L.B. Creemers, J. Stauber, R.J. Vreeken, B. Cillero-Pastor, S.R. Ellis, and R.M.A. Heeren, Anal. Chem. 91(16), 10840–10848 (2019).
(12) “Caution!MALDI-2 detects analyte classes never seen before,” Application Note, Bruker Daltonics (2020).
(13) J. Soltwisch, B. Heijs, A. Koch, S. Vens-Cappell, J.Höhndorf, and K. Dreisewerd, Anal. Chem. 92(13), 8697–8703 (2020).
-
科技前沿

-
企业风采

-
焦点事件