知识分享:PCR仪的原理、分类、常见问题汇总!
一、PCR的基本原理
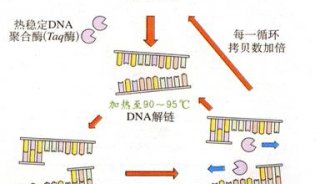
聚合酶链反应(polymerasechain reaction,PCR)PCR反应过程与细胞内的DNA复制相似,但PCR的反应体系要简单的多,主要包括DNA靶序列、引物、4种单核苷酸dNTP、耐热DNA聚合酶以及合适的缓冲液体系。
PCR反应过程有以下3个步骤:1、变性将反应体系混合物加热到94
℃,维持较短时间(大约15 s-30 s),使目标DNA双螺旋的氢键断裂,形成单链DNA作为反应模板。2、退火将反应体系冷却至特定的温度(引物的TM值左右或以下),引物与DNA模板的互补区结合,形成模板引物复合物。3、延伸将反应体系的温度提高到72
℃并维持一段时间,引物在耐热聚合酶的作用下,以引物为固定起点,以4种单核苷酸(dNTP)作为底物合成新的DNA链。
以上三步作为一个循环重复的进行,每一循环的产物作为下一循环的模板。如此循环数十次,从而使目的基因得到指数级扩增,达到检测或获取基因的目的。
二、PCR仪的分类
根据DNA扩增的目的和检测的标准可以将PCR仪分为:普通PCR仪,梯度PCR仪,原位PCR,实时荧光定量PCR仪等几类。
2.1普通PCR仪
一般把一次PCR扩增只能运行一个特定退火温度的PCR仪,称之为普通PCR仪。
如果要用它做不同的退火温度则需要多次运行。主要是用作简单的,对目的基因退火温度的扩增。主要应用于科研、教学、临床医学、检验、检疫等。
2.2
梯度PCR仪
一次性PCR扩增可以设置一系列不同的退火温度条件(通常12种温度梯度)的称之为梯度PCR仪。
因为被扩增的不同的DNA片段其最适合的退火温度不同,通过设置一系列的梯度退火温度进行扩增,从而一次性PCR扩增就可以筛选出表达量高的最适合退火温度进行有效的扩增。主要用于研究未知DNA退火温度的扩增,这样既节约时间,也节约经费。
在不设置梯度的情况下亦可当做普通的PCR用。真正的梯度,是每一排管都有精确的加热控温探头。
梯度PCR仪多应用于科研、教学机构。
2.3原位PCR仪
有些品牌的PCR仪具有普通PCR、梯度PCR、原位PCR的功能,通过替换模块进行多用途开展实验工作。是用于从细胞内靶DNA的定位分析的细胞内基因扩增仪。如病原基因在细胞的位置或目的基因在细胞内的作用位置等。可保持细胞或组织的完整性,使PCR反应体系渗透到组织和细胞中,在细胞的靶DNA所在的位置进行基因扩增。
不但可以检测到靶DNA,还能标出靶序列在细胞内的位置。于分子和细胞水平上研究疾病的发病机理和临床过程及病理的转变有着重大的实用价值。
2.4
实时荧光定量PCR仪(fluorescencerquantitive polymerase chain reaction, FQPCR)
在普通PCR仪设计基础上增加荧光信号激发和采集系统和计算机分析处理系统,形成了具有荧光定量PCR功能的仪器。
其PCR扩增原理和普通PCR扩增原理相同,在PCR扩增时加入的引物是利用同位素、荧光素等进行标记,使用引物和荧光探针同时与模板特异性结合扩增。扩增的结果通过荧光信号采集系统实时采集信号连接输送到计算机分析处理系统,得出量化的实时结果输出。
荧光定量PCR仪有单通道,双通道和多通道之分。当只用一种荧光探针标记的时候,选用单通道;有多种荧光标记的时候使用多通道。单通道也可以检测多荧光的标记和目的基因表达产物,因为一次只能检测一种目的基因的扩增量,需多次扩增才能检测完不同的目的基因片段的量。多通道利于做多重PCR,实现一次检测多种目的基因的功能。
实时荧光定量PCR仪主要应用于临床医学检测、生物医药研发、食品行业、科研院校等。
实时荧光定量PCR仪+实时荧光定量试剂+通用电脑+自动分析软件,构成PCR-DNA/RNA实时荧光定量检测系统。
实时荧光定量PCR的优势:
荧光定量PCR仪比普通的PCR仪多了荧光信号采集系统和计算机分析处理系统,实时荧光定量PCR仪主要是用来定量分析和确定基因转录水平的,而普通的PCR仪是做定性分析和扩增基因片段,定量PCR仪可以做普通PCR仪的工作,但是成本太高。
样品到达域值水平所经历的循环数称为Ct值(限制点的循环数)。域值应设定在使指数期的扩增效率为最大,这样可以获得最准确,可重复性的数据。如果同时扩增的还有标有相应浓度的标准品,线性回归分析将产生一条标准曲线,可以用来计算未知样品的浓度。
荧光定量PCR仪特点:
1.特异性强:引物和探针的“双保险”,避免检测的假阳性。2.灵敏度高:分析PCR产物的对数期,自动化仪器收集荧光信号,避免了许多人为因素干扰。3.避免污染:全封闭反应,无须PCR后处理。4.实现定量:运用标准品获得标准曲线,结合Ct值进行准确定量。5.高效低耗:可实现一管多检。6.操作简便:在线式实时监测扩增结果,不必接触有害物质。7.快速:反应时间<1.5小时。
三、PCR常见问题汇总
1.无扩增条带
(1)酶失活或在反应体系中未加入酶。Taq DNA聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。(2)模板含有杂质。特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA脱嘌呤而影响PCR的结果。(3)变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。(4)反应系统中污染了蛋白酶及核酸酶,应在未加Taq酶以前,将反应体系95℃加热5-10分钟。(5)引物变质失效。人工合成的引物是否正确。是否纯化,或因储存条件不当而失活。(6)引物错误。利用BLAST检查引物特异性或重新设计引物。(7)DNA凝胶电泳时加入阳性对照,确保不是DNA凝胶和PCR程序的问题。
2.PCR产物量过少
(1)
退火温度不合适。以2度为梯度设计梯度PCR反应优化退火温度。(2)
DNA模板量太少。增加DNA模板量。(3)
PCR循环数不足。增加反应循环数。(4)
引物量不足。增加体系中引物含量。(5)
延伸时间太短。以1kb/分钟的原则设置延伸时间。(6)
变性时间过长。变性时间过长会导致DNA聚合酶失活。(7)
DNA模板中存在抑制剂。确保DNA模板干净
3.扩增产物在凝胶中涂布或成片状条带弥散
(1)酶量过高。减少酶量;酶的质量差,调换另一来源的酶。(2)dNTP浓度过高。减少dNTP的浓度。(3)MgCl2浓度过高。可适当降低其用量。(4)模板量过多。质粒DNA的用量应<50ng,而基因组DNA则应<200ng。(5)引物浓度不够优化。对引物进行梯度稀释重复PCR反应。(6)循环次数过多;增加模板量减少循环次数至30,缩短退火时间及延伸时间,或改用二种温度的PCR循环。(7)退火温度过低。(8)电泳体系有问题:①凝胶中缓冲液和电泳缓冲液浓度相差太大;②凝胶没有凝固好;③琼脂糖质量差。(9)若为PCR试剂盒则可能:①由于运输储存不当引起试剂盒失效;②试剂盒本身质量有问题,如引物选择、循环参数等选择不当。(10)降解的陈旧模板扩增也易产生涂布。
4.扩增产物出现多条带(杂带)
(1)引物用量偏大,引物的特异性不高。应调换引物或降低引物的使用量。(2)循环的次数过多。适当增加模板的量,减少循环次数。(3)酶的用量偏高或酶的质量不好,应降低酶量或调换另一来源的酶。(4)退火温度偏低,退火及延伸时间偏长。应提高退火温度,减少变性与延伸时间,也可采用二种温度的PCR扩增。以2度为梯度设计梯度PCR反应优化退火温度。(5)样品处理不当。(6)Mg2+浓度偏高,因适当调整Mg2+使用浓度。(7)若为PCR试剂盒,也可能时试剂盒本身质量有问题。(8)
复制提前终止。使用非热启动的聚合酶时常有发生。冰上准备反应体系或采用热启动聚合酶。(9)
反应缓冲液未完全融化或未充分混匀。确保反应缓冲液融化完全并彻底混匀。(10)
引物特异性差。利用BLAST检查引物特异性或重新设计引物。(11)
引物量过多。减少反应体系中引物的用量。(12)
模板量过多。质粒DNA的用量应<50ng,而基因组DNA则应<200ng。(13)
外源DNA污染。确保操作的洁净。
5.阴性对照出现条带
试剂,枪头,工作台污染。使用全新的试剂和枪头,对工作台进行清洁。
6.条带大小与理论不符
1)
污染。使用全新的试剂和枪头,对工作台进行清洁。2)
模板或引物使用错误。更换引物和模板。3)
基因亚型。对研究的基因进行序列分析和BLAST研究。