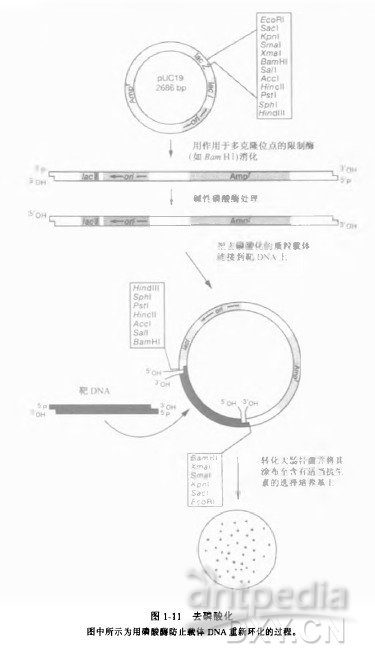
去除 5' 端的磷酸基可防止质粒 DNA 的自身连接和环化。在体外连接反应中,DNA 连接酶可在邻近的两个分子间形成磷酸二酯键。但只有当一个分子的 5' 端带有磷酸基另一分子的 3' 端带有羟基时,这一反应才能完成。本实验来源「分子克隆实验指南第三版」黄培堂等译。
| 实验方法原理 | 去除 5' 端的磷酸基可防止质粒 DNA 的自身连接和环化。在体外连接反应中,DNA 连接酶可在邻近的两个分子间形成磷酸二酯键。但只有当一个分子的 5' 端带有磷酸基另一分子的 3' 端带有羟基时,这一反应才能完成。 |
|---|
| 实验材料 | 小牛肠碱性磷酸酶(CIP) 或虾碱性磷酸酶(SAP)蛋白酶 K限制性内切核酸酶载体 DNA |
|---|
| 试剂、试剂盒 | EDTAEGTA乙醇酚氯仿SDSTETris-Cl |
|---|
| 仪器、耗材 | 琼脂糖凝胶水浴 |
|---|
| 实验步骤 | 一、材料
1. 缓冲液和溶液
EDTA ( 0.5 mol/L,pH 8.0),EGTA ( 0.5 mol/L,pH 8.0),乙醇,酚,酚:氯仿(1:1,V/V), SDS (10%,m/V),乙酸钠(3 mol/L pH 5.2 和 pH 7.0),TE ( pH 8.0),Tris-Cl ( 10 mmol/L,pH 8.3)。
2. 酶与缓冲液
小牛肠碱性磷酸酶(CIP) 或虾碱性磷酸酶(SAP),蛋白酶 K ( 10 mg/ml),限制性内切核酸酶。
3. 凝胶
琼脂糖凝胶(0.7%),用含有 0.5 μg/ml 溴化乙锭的 TBE 制备。
4. 核酸和寡核苷酸
载体 DNA ( 闭环质粒)。
5. 专用设备
可调至 56℃ 或 65℃ 的水浴。
二、方法
1. 用 2~3 倍过量的限制酶消化一份合理量(10 μg) 的闭环质粒 DNA 1 h。
2. 取出一小份(0.1 μg) DNA,用含有溴化乙锭的琼脂糖凝胶(0.7%) 电泳检査消化程度,用未被消化的质粒 DNA 作对照。如消化不完全,应添加更多的酶继续消化。
3. 如已消化完全,用酚:氯仿抽提一次,再用乙醇沉淀回收 DNA。将乙醇溶液置于冰上 15 min。
4. 于 4℃ 用最大转速离心回收 DNA,用 110 μl 10 mmol/L Tris-Cl ( pH 8.3) 溶解 DNA。
保留 20 μl 的 DNA 以备以后用作对照。
5. 向余下的 90 μl 线状 DNA 中加入 10 μl 10X CIP 或 10X SAP 缓冲液和适量的小牛肠碱性磷酸酶(CIP) 或虾碱性磷酸酶(SAP) 并按表 1-8 中的方法进行温育。

6. 灭活磷酸酶:
灭活 CIP:在达到温育时间后,加入 SDS 和 EDTA ( pH 8.0) 使终浓度分别为 5% 和 5 mmol/L,充分混匀,再加入蛋白酶 K 使终浓度为 100 μg/ml,于 55℃ 温育 30 min。也可在 5 mmol/L EDTA 10 mmol/L EGTA ( pH 8.0 ) 存在的条件下于 65℃ 温育 30 min 使 CIP 失活(或 75℃ 10 min)。
或
失活 SAP:在去磷酸化缓冲液中使反应混合物于 65℃ 温育 15 min。
去磷酸化反应结束后,在进行连接反应前去除或使碱性磷酸酶完全失活是很重要的。尽管 CIP 或 SAP 都可通过上述方法失活,但我们仍建议在使用去磷酸化的 DNA 进行连接之前最好用酚:氯仿抽提一下去磷酸化反应的混合物。
7. 使反应混合物冷至室温,而后用酚抽提一次,再用酚:氯仿抽提一次。
8. 用乙醇沉淀法回收 DNA。再次混匀溶液,置于冰上 15 min。
9. 于 4℃ 用最大转速离心回收 DNA,用 70% 乙醇洗涤 DNA 沉淀,于 4℃ 再次离心。
10. 小心弃去上清液,将开盖的离心管置于工作台直至乙醇蒸发殆尽。
11. 用 TE ( pH 8.0) 溶解沉淀的 DNA 使浓度为 100 μg/ml。以小份分装 DNA 于 -20℃ 保存。
 |
|---|