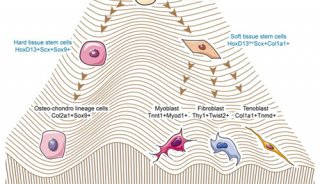
双转基因模型证明干细胞促进再生新理论
《JCI-Insight》杂志近期发表了他们的研究成果——注射后,干细胞通过协调内源性细胞导致愈合效果,并不直接负责软骨再生。
间充质干细胞(所谓的结缔组织祖细胞)在治疗软骨组织再生领域极具潜力,但是,干细胞疗法如何促进受损结缔组织愈合的机制尚不明确。生物医学科学系的研究者为解决这一问题首先需要克服一个障碍:用于追踪干细胞的标记蛋白属于非自身蛋白,这种标签会导致注射干细胞被免疫排斥。
新模型演示干细胞的作用方式
“在活动物体内直接追踪注射干细胞的活动是不可能的,”通讯作者Reinhold Erben解释道。“你需要先利用特殊蛋白标记干细胞,可是它们都是能被免疫系统识别的非内源性蛋白,因此可能存在副作用,排斥反应会阻碍注射细胞的作用方式,影响验证结果。”
研究人员认为唯一的途径是利用免疫缺陷动物模型,通过遗传手段减弱免疫系统,让机体对标签蛋白质不再反应。然而,这类动物模型也不能很好的反映干细胞活动的真实情况。“为此,我们研制了一种更写实的,拥有免疫活性,但对我们的追踪分子没有反应的模型。这是一个纯粹的研究干细胞在软骨损伤治疗中作用的动物模型,”Erben说道。
“于是,我们创建了一种双转基因动物模型,”Erben说。“人工诱导受体和供体小鼠和大鼠表达人类细胞表面蛋白,胎盘碱性磷酸酶(placental alkaline phosphatase, ALPP),使细胞可被追踪。受体品系的ALPP与供体的具有1个氨基酸的差异,但是对免疫系统来说,两种蛋白质变体几乎完全相同,因此从供体到受体的移植不会出现排斥。此外,受体ALPP的突变使蛋白质在高温下的热稳定性失活,通过实验能与供体蛋白加以区分。”
新系统——干细胞疗法的动力
这种突变追踪蛋白迷糊免疫系统的理念可推广至其他动物模型。除了ALPP,绿色荧光蛋白(GFP)和荧光素酶(luciferase)等常见蛋白标记也都可以尝试使用这种方法。“与其他追踪分子相比,结合两种变体的策略更适用于干细胞研究,”Erben说。
无免疫活性损耗的双转基因系统让干细胞治疗软骨再生的过程更加清晰。在干细胞逐渐渗透至癌症治疗、神经退行性疾病治疗、组织再生医学、甚至医疗美容等方方面面领域的今天,任何一种新方法都有潜力扩大人类对干细胞未知领域的深入了解。
-
技术原理
-
科技前沿