小鼠破骨细胞分化方案
| 破骨细胞是高度分化的多核巨细胞,主要来源于单核/巨噬细胞造血干细胞系,是一种具有骨吸收功能,在骨代谢方面起着关键性作用的细胞,因而机体对于破骨细胞的调控非常严格,在破骨细胞分化成熟的过程中,RANK /RANKL/OPG系统起着分化调控枢纽的作用,是调节破骨细胞分化成熟的关键信号途径。核因子κB 受体活化因子配体(Receptor Activator for Nuclear Factor-κB Ligand ,RANKL)被认为是促进破骨细胞最为分化成熟及其功能活性最重要的因子,M-CSF可诱导RANK在破骨细胞前体的细胞膜上表达,进而使表达RANK的破骨前体细胞和RANKL结合并产生效应,诱导破骨细胞分化。因此在体外诱导破骨细胞分化过程中RANKL和M-CSF两种细胞因子缺一不可。 |
| 然而有不少科研工作者在诱导分化破骨细胞(尤其是小鼠破骨细胞)时会遇到诱导不稳定,诱导效率低等问题,PeproTech技术部门通过实验总结以及查阅文献对诱导失败原因进行了分析: ▼ 破骨细胞的诱导是通过破骨前体细胞融合形成多核巨细胞,因此细胞的密度对融合很关键,人的破骨细胞体外分化通常由单核细胞进行分化诱导,由于是分选的细胞,纯度很高,在诱导分化过程中细胞不会增殖,因此细胞密度可控,诱导成功率高;而小鼠的破骨细胞体外诱导分化是选择骨髓细胞来进行诱导,骨髓细胞里面虽然有很多破骨前体细胞,但是在诱导分化过程中其它杂细胞会影响细胞之间的融合,此外在前期扩增过程中,细胞生长速度的差异最终会引起细胞密度的不可控,最终也会影响细胞的融合,导致诱导分化的失败。 |
| 为了给客户解决这一问题,PeproTech技术部门通过实验操作验证总结了一个新的小鼠破骨细胞诱导诱导方案,供大家参考! |
|
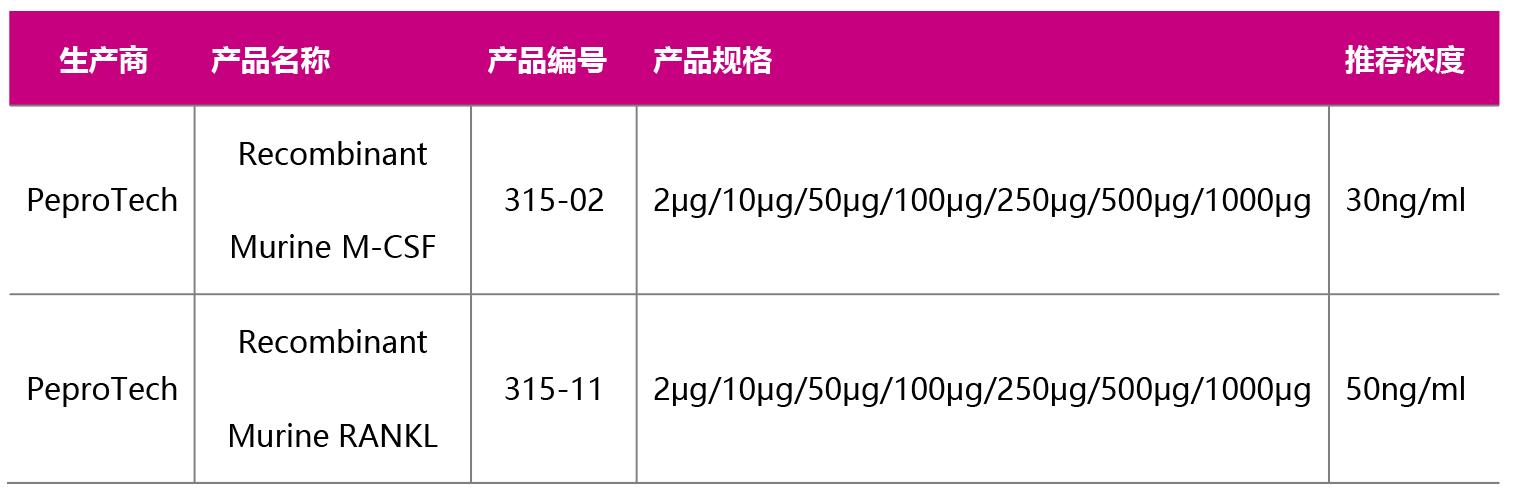
1. 小鼠骨髓细胞的获得 1.1 小鼠(6~8周)颈椎脱臼法处死,将处死的小鼠放于含有酒精的小烧杯中浸泡2 min,消毒灭菌,在超净台中手术取出所有的胫骨和股骨,并用剪刀和镊子将骨周围的肌肉组织尽量去除干净; 1.2 将取好的骨头转移到装有无菌PBS的培养皿中,涮洗一次后转移至另一个装有无菌PBS的培养皿; 1.3 用剪刀剪去骨的两端,再用注射器抽取PBS,针头分别插入两端骨髓腔中,用注射器打入PBS,反复冲洗骨髓至培养皿中,直至骨完全变白; 1.4 收集骨髓悬液,用筛网过滤去除小碎片和肌肉组织; 1.5 将滤过液500 g/5 min离心,弃去上清; 1.6 将离心后的沉淀弹散,加入2 ml红细胞裂解液(1X)(Cat#64010-00-100),室温裂解5 min 注:推荐使用BioGems红细胞裂解液,裂解温和,对骨髓细胞损伤小! 1.7 加入10 ml完全培养基(α-MEM培养基+10%FBS+双抗)终止裂解,然后500 g/5 min离心,弃去上清; 1.8 将离心后的沉淀弹散,用完全培养基(α-MEM培养基+10%FBS+双抗)重悬细胞,至此已获得小鼠骨髓细胞。 2. 巨噬细胞诱导分化 2.1 将细胞重悬到1-2*106/ml,加入终浓度为30ng/ml的小鼠M-CSF,按10cm的细胞培养皿中加入10ml细胞悬液铺板,隔天换液一次,诱导分化5天待细胞长到80-90%密度,镜下细胞都贴壁生长。 2.2 弃去培养皿内培养基,加入PBS清洗细胞一次,加入一定量的胰酶在37℃进行消化,待细胞开始变松散后加入血清及时终止消化,轻柔吹打细胞,将细胞收集到15ml离心管内,离心弃去上清。 3. 破骨细胞诱导分化 3.1. 用诱导分化培养基(完全培养基+30ng/ml Murine M-CSF+50ng/ml Murine RANKL)重悬细胞。 3.2. 请按下表铺入细胞数及对应的体积: |
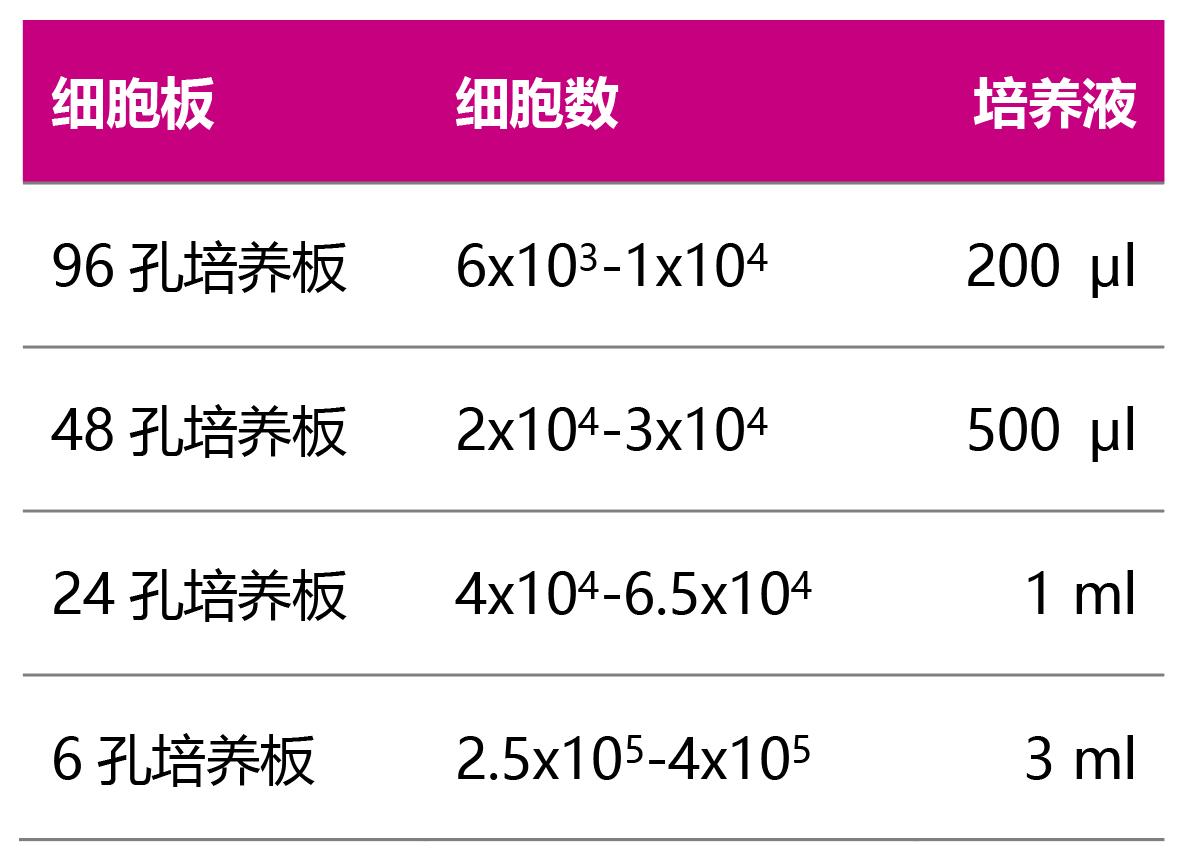 |
|
3.3 培养分化3~5天,隔天换液,一般在培养分化的第三天可以看到细胞融合,多个核细胞形成,此后要及时观察融合情况,因为融合后的破骨细胞体外生存时间较短,容易破裂,要挑选合适的时间终止分化,进行下游实验。 注:细胞因子购买后请按照说明书指示溶解并稀释保存,不可反复冻融,诱导分化培养基请根据每次的用量配制,用多少,配制多少。 |
 |
| 诱导结果: |
 |







