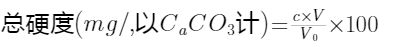简单理化指标监测内容及方法--感官物理性质
1颜色
色度是水样颜色深浅的量度。某些可溶性有机物、部分无机离子和有色悬浮微粒均可使水着色。因而,水的颜色与水的种类有关,如纯水是无色透明的;天然水的颜色主要来源于水生植物和浮游生物、腐殖质、泥砂、金属离子或矿物质等;生活污水和工业废水因含多种有机、无机组分而呈现多种不同的颜色,且常常因排放而使环境水体着色。
同水的颜色有真色和表色两种。真色是去除了水中悬浮物质以后的颜色,是由水中胶体物质和溶解性物质所造成的。表色是指没有去除悬浮物质的水所具有的颜色。水质分析中水的色度是指真色。
水质标准中对颜色的规定主要是基于感官上不能引起不快。一般来讲,水的色度在卫生方面意义不是最大,水体色度主要会降低水体的透光性,从而影响水生生物的生长。在测定水的色度之前,要先将水样静置澄清或离心取其上清液,也可用孔径为0.45μm的滤膜过滤去除悬浮物,但不可以用滤纸过滤,因滤纸可能会吸附部分真色。主要的测定方法有铂钴标准比色法(GB 11903—89)和稀释倍数法(GB 11903—89)。
(1)铂钴标准比色法和铬钴比色法 铂钴标准比色法是将一定量的氯铂酸钾(K2PtCl6)氯化钴(CoCl2·6H2O)溶于水中配成标准色列,并定义1L水中含1mg铂和0.5mg钴所具有的颜色为1度。将待测水样与标准色列进行目视比色,以确定其色度。该法所配成的标准色列性质稳定,可较长时间存放。
由于氯铂酸钾价格较贵,可以用铬钴比色法代替进行色度的测定。即将一定量重铬酸钾和硫酸钴溶于水中制成标准色列。进行目视比色确定待测水样的色度。该法所制成标准色列的保存时间比较短。
若水样经稀释后与标准色列目视比色,则所测色度需乘上其稀释倍数方为原水样的色度。需要说明的是,以上两种方法因所配制的标准色列为黄色,因此只适用于较清洁且具有黄色色调的饮用水和天然水的测定。若水样为其他颜色,无法与标准色列进行比较,则可用适当的文字描述其颜色和色度,如淡蓝色、深褐色等。
(2)稀释倍数法稀释倍数法主要用于生活污水和工业废水颜色的测定。将经预处理去除悬浮物后的水样用无色水逐级稀释,当稀释到接近无色时,记录其稀释倍数,以此作为水样的色度,单位是“倍”。同时用文字描述废水颜色的种类,如棕黄色、深绿色、浅蓝色等。
2固体物质
水中的固体是指在一定的温度下将水样蒸发至干时所残余的那部分物质,因此也曾被称为“蒸发残渣”。严格来讲,水中固体应当包括除溶解气体以外的其他一切杂质。
水中固体有各种分类。将水样置于容器中蒸发至近干,再放在烘箱中在一定温度下烘干至恒重,如此所得的固体称为“总固体”。根据溶解性的不同可分为“溶解固体”和“悬浮固体”。一般,将能通过0.45μm或更小孔径滤纸或滤膜的那部分固体称作溶解固体,不能通过的称作悬浮固体。根据挥发性的不同,水中固体又可分为“挥发性固体”和“固定性固体”。挥发性固体是指在一定温度下(通常为550℃)将水样中固体灼烧一段时间后所损失的那部分物质的质量,又称“灼烧减重”;灼烧后所留存的那部分物质的质量则称作“固定性固体”。固定性固体可以大约代表水中无机物质的含量,挥发性固体可以大约代表水中有机物质的含量。因为在550℃下,有机物全部被分解成CO2和H2O而挥发,而无机盐类除了铵盐和碳酸镁在此温度下都相当稳定。有关反应式如下:

在废水测定中还有一个“可沉固体”的指标,是指在一定条件下悬浮固体中所能沉下的那部分固定的量。
水中固体的测定有着重要的环境意义。若环境水体中的悬浮固体含量过高,不仅影响景观,还会造成淤积,同时也是水体受到污染的一个标志。溶解性固体含量过高同样不利于水的功能的发挥。如溶解性的矿物质含量过高,既不适于饮用,也不适于灌溉,有些工业用水(如纺织、印染等)也不能使用含盐量高的水。在废水处理过程中,固体尤其是悬浮固体和可沉固体的含量是重要的设计参数。
烘干条件对水中固体测定结果的影响很大。因为固体质量的变化与有机物、机械吸着水和结晶水的挥发,加热引起的化学分解,以及氧化引起的增重等都有关系,而这些变化是受烘干温度和烘干时间影响的。残渣在103~105℃烘干时,结晶水和部分吸着水得以保留,但重碳酸盐分解变为碳酸盐会损失二氧化碳和水,该温度下有机物的挥发量很少。
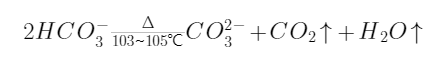
当烘干所用的温度为(180±2)℃时,几乎所有的机械吸着水都将损失掉,当硫酸盐含量高时,部分结晶水仍可能留下来,有机物部分挥发,部分氯化物和硝酸盐可能会损失。般而言,180℃烘干时所测得溶解性固体的量较103~105℃烘干时所测得溶解性固体的量更接近水样的实际含盐量。
当水中油或脂的含量较高时,因很难将样品烘至恒重,所以较难得到准确的测定结果。
水中固体采用重量法测定,结果以mg/L为单位表示
(1)103~105℃烘干的总固体将混合均匀的水样在称至恒重的蒸发皿中于蒸气浴或水浴上蒸干,并置于103~105℃烘箱内烘至恒重。蒸发皿两次恒重后,称量所增加的质量即为总固体。计算方法如下: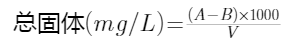
注意事项:所取水样体积以其中含10~200mg固体为宜。若太少称量误差大,太多则易影响吸着水蒸发。
若水样中含有较高浓度的钙、镁、氯化物和硫酸盐等易吸水的化合物时,可能要延长烘干所需的时间,并且要注意干燥和迅速称量。采集水样时,要排除巨大的漂浮物和成团的非均匀物,并撇开表面漂浮的油和脂。
(2)180℃烘干的溶解性总固体将一定体积经过滤后的水样放在称至恒重的蒸发皿内蒸干,然后在(180±2)℃烘至恒重。蒸发皿两次恒重后,称量所增加的质量即为180℃烘干的溶解性总固体。在该温度下,水样中吸着水几乎全被赶尽,所得结果与通过化学分析计算所得总矿物质含量较接近。
计算方法同103~105℃烘干的总固体。
年注意事项同总固体测定。若水样中重碳酸盐含量高,则需延长烘干时间以确保重碳酸盐充分转变为碳酸盐。
(3)103~105℃烘干的总悬浮固体 水样经过滤后,留在过滤器材上的固体物质,在103~105℃烘至恒重所称得的质量减去过滤器材自身的质量,即为总悬浮固体。
计算方法参照总固体计算公式。
(4)550℃灼烧所测得的挥发性和固定性固体将蒸发皿先在升温至550℃的马弗炉中灼烧1h,干燥冷却后称其质量并用来测定水样的总固体,方法与103~105℃烘干的总固体测定方法基本相同。然后,将含有总固体物质的蒸发皿再放入冷的马弗炉中,加热到550℃,灼烧1h,取出后在干燥皿中冷却,如此反复称至恒重,所损失的质量即为挥发性固体的含量,所留存的质量即为固定性固体的含量,计算方法如下:
注意事项:灼烧后固体极易吸收空气中的水分,称重操作一定要迅速。
(5)可沉固体 可沉固体有体积比(mL/L)和质量体积比(mL/L)两种测定和表示方法。
①体积比。将1L混合均匀的水样倒入 Imhoff锥形筒中,使其静置沉降1h,读取所沉下来的固体的体积,以mL/L表示可沉固体含量。若在大的沉降颗粒之间含有液体,则估算扣除其体积后得到可沉固体的体积。
②质量体积比。将混合均匀的水样(不少于1L)倒入一直径不小于9cm的玻璃容器中,使水深不小于20cm,静置沉淀1h,在上清液的中间部位用虹吸法取出250mL上清液,测其悬浮固体的含量(mg/L),作为水样中不可沉固体的含量,另外单独测定原水样总悬浮固体的含量(mg/L),二者之差即为水样中可沉固体的含量(mg/L),计算如下:
可沉固体(mg/L)=总悬浮固体(mg/L)-不可沉固体(mg/L)
(6)混合液挥发性悬浮固体(mixed liquor volatile suspended solids MLVSS)在废水处理工艺中,通常用混合液挥发性悬浮固体(MLVSS)浓度来表示活性污泥曝气池中的微生物含量状况。具体做法是从曝气池中取一定体积的混合液,用定量滤纸过滤,首先在103~105℃烘干测得混合液固体(MLSS)的含量,然后在550℃灼烧测挥发性固体(VSS)的含量,所测得的VSS除以混合液体积即为 MLVSS,单位一般用mg/L表示。
上述各种固体的定量测定都是通过烘干、恒重及称量等步骤的多次重复才完成的,虽然方法十分简单,但每一项指标的测定时间都在5h以上。最近报道了一种可以克服上述缺点的新方法,即快速测定水中悬浮性物质(SS)的减码水分分析仪法。该水分分析仪主要由温度可控的红外灯加热装置和精密天平组成,具有样品加热和称重的双重功能。利用了红外加热原理,样品干燥均匀,恒重时间短,因此也大大缩短了分析时间,整个烘干称量过程仅需5~20min。应该说,减码水分分析仪法具有广泛的应用前景。
3硬度
最初,水的硬度被用来度量水沉淀肥皂的容量。水的硬度是由多价金属阳离子造成的,这些离子能与肥皂生成沉淀,并与部分阴离子形成水垢。
Ca2++2Na(C17H35 COO)→2Na++Ca(C17 H35COO)2
造成硬度的阳离子主要是二价金属离子,如Ca2+、Mg2+、Sr2+、Fe2+、Mn2+等,与它们易结合形成水垢的阴离子主要是HCO3-、SO42-、Cl-、NO3-和SiO3-等A13+和Fe3+也会造成水的硬度,但在天然水中它们的溶解度很小,可以忽略不计。总之,由于Ca和Mg在地球上是丰度排名第五和第八位的元素,水的硬度绝大部分是由Ca和Mg造成的。
水的硬度按相关阳离子可分为“钙硬度”和“镁硬度”,按相关的阴离子可分为“碳酸盐硬度”和“非碳酸盐硬度”。其中,碳酸盐硬度主要是由与重碳酸盐所结合的钙、镁所形成的硬度,因其在煮沸时即分解生成白色沉淀物,可以从水中去除,因此又被称为“暂硬度”。
非碳酸盐硬度是由钙、镁与水中的硫酸根、氯离子和硝酸根等结合而形成的硬度,这部分硬度不会被加热去除,因而又被称为“久硬度”。钙硬度和镁硬度之和称为总硬度,碳酸盐硬度和非碳酸盐硬度之和亦称为总硬度。硬度一般以CaCO3计,以mg/L为单位。
水的硬度因地而异。在土层较厚和石灰岩存在的地区水较硬;在土层较薄和石灰岩稀少的地区水较软。这是因为土壤中细菌的活动会释放出CO2,与水结合生成碳酸,造成pH值下降,从而将石灰岩溶解形成重碳酸盐,造成水的硬度增大。基于上述原因,一般情况下,同一地区地下水的硬度要比地表水高。
对饮用水和生活用水而言,硬度过高的水虽然对健康并无害处,但口感不好,且会消耗大量洗涤剂,因此我国生活饮用水卫生标准将总硬度限定为不超过450mg/L(以CaCO3计)工业用水对硬度的限定往往更为严格,这是因为硬度高的水会在锅炉内生成水垢,从而降低锅炉的传热能力,浪费能源。水垢还会堵塞冷却水管路系统。另外,水的硬度还影响到纺织、印染、造纸、食品加工等行业的产品质量。
硬度的测定方法主要有计算法和EDTA滴定法(GB 7477—87)。
(1)计算法 用原子吸收光谱法分别测定水中Ca和Mg的含量,通过下列公式计算得到总硬度:
(总硬度(mg/L,以CaCO3计)=2.497[Ca,m/L]+4.118[Mg,mg/L]
(2)EDTA滴定法在pH=10条件下,用乙二胺四乙酸(EDTA)或其钠盐作为滴定剂,以铬黑T(EBT)作为指示剂与水样进行反应,根据所消耗的EDTA的量,可求得水样的总硬度。
测定原理及方法简述如下。
①控制溶液的pH值是有效地进行络合滴定的重要条件之一,因此在测定总硬度时,要先用缓冲溶液将被测水样的pH值调整到10左右。然后,加入指示剂铬黑T(本身是蓝色的),使其与水中的Mg2+生成酒红色络合物,即
Mg2++EBT→EBT-Mg
这种EBT-Mg络合物的稳定常数K1=107.0。
②用EDTA溶液滴定。EDTA可与水中游离的Ca2+、Mg2+生成无色络合物,即
Ca2++EDTA→EDTA-Ca,K2=1010.7
Mg2++EDTA→ EDTA-Mg, K3=108.7
由于K2>K3,滴定加入的EDTA优先与Ca2+络合,再与Mg2+络合。
③继续滴加EDTA。当溶液中游离的Ca2+、Mg2+均被络合完毕后,由于K3>K1,即EDTA-Mg络合物比EBT-Mg络合物更为稳定,继续滴入的EDTA可以从EBT-Mg络合物中夺取Mg2+而使指示剂铬黑T游离出来。随着反应的进行,溶液的酒红色逐渐变淡,到达反应终点时,突变为铬黑T的亮蓝色。
EBT-Mg+EDTA→EDTa-Mg+EBT
酒红色 蓝色
滴定终点时,颜色变化(由酒红色再变为蓝色)的明显程度随着pH值的提高而增加。但pH值不能无限地提高,否则CaCO3或Mg(OH)2可能沉淀出来,而且pH值过高时,铬,黑T也将变为橙色。
根据滴定所用去的EDTA总量,即可求得水样的总硬度。计算式为: