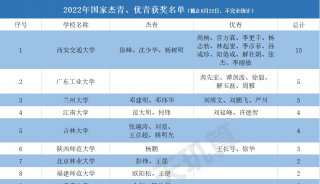
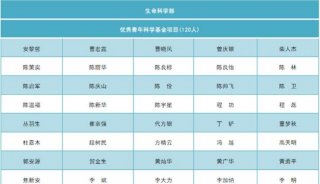
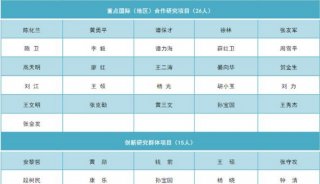
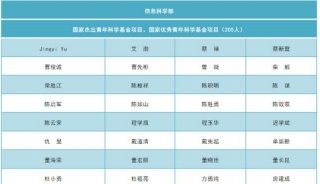
安进/优时比向FDA再次提交骨质疏松症新药Evenity上市申请
美国生物技术巨头安进(Amgen)与合作伙伴优时比(UCB)近日联合宣布,已重新向美国食品和药物管理局(FDA)提交骨质疏松症新药Evenity(romosozumab)的生物制品许可申请(BLA),用于存在骨折高风险的绝经后女性治疗骨质疏松症。
Evenity是一种全人源化单克隆抗体,通过抑制骨硬化蛋白(sclerostin)的活性发挥作用,该药具有双重作用,促进骨形成的同时可减少骨吸收,增加骨密度(BMD),降低骨折风险。除了FDA之外,Evenity也正在接受欧洲药品管理局(EMA)和日本药品和医疗器械管理局(PMDA)的审查。
骨硬化蛋白又名硬骨素,由骨硬化蛋白基因(SOST)编码,是一种分泌型糖蛋白。体内研究证明,骨硬化蛋白特异性地表达于骨细胞(osteocyte)中,通过作用于成骨细胞而在骨代谢中起重要作用。SOST基因的表达受应力作用、激素、氧浓度等因素的影响。拮抗骨硬化蛋白可以缓解骨质疏松的症状,这为临床治疗骨质疏松等疾病提供了新思路与新方法。
2016年7月,安进和优时比首次向FDA提交了Evenity的BLA,其中纳入了一个广泛的I期和II期项目以及一项入组了7180例绝经后骨质疏松症女性患者的III期临床研究FRAME。但在2017年7月,FDA发布一封完整回应函(CRL)拒绝批准Evenity,要求将另一项III期临床研究ARCH研究的有效性数据和安全性数据以及在骨质疏松症男性患者中开展的III期临床研究BRIDGE的数据纳入BLA中。
因此,此次重新提交的BLA中增加了来自这2个关键性III期临床研究的数据,其中:ARCH研究是一项阿仑膦酸活性药物对照研究,纳入了4093例经历过骨折的绝经后骨质疏松症患者,BRIDGE研究则纳入了245例骨质疏松症男性患者。FDA将开始评估临床益处:Evenity的风险轮廓(包括ARCH研究中所观察到的心血管安全信号)以及该药在绝经后女性骨质疏松症患者中降低骨折风险及增加BMD的潜力。
安进研发执行副总裁Sean E. Harper表示,骨质疏松症导致的骨折可能是一种改变生命的事件,Evenity在由于先前骨折导致的高风险患者中具有降低骨折的风险。我们期待着与FDA合作,为患者带来这个创新的治疗方案,解决该领域存在的一个严重未满足的医疗需求。
-
财报

-
焦点事件
-
焦点事件
-
焦点事件