Cell:重磅!首次破解人cGAS的三维结构
人体是为生存而建造的。人体中的每一个细胞都受到一组免疫蛋白的严密保护,而且这些免疫蛋白装备了几乎万无一失的雷达来检测外来的或受损的DNA。
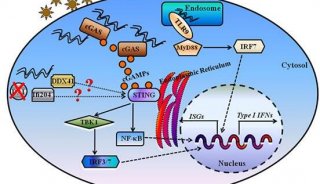
人细胞中的一个最为关键的哨兵是一种被称作cGAS的“第一响应者”蛋白,它检测外来的和发生癌变的DNA的存在,并启动一种信号级联反应,从而触发身体防御。
2012年蛋白cGAS的发现引发了科学探究的风暴,迄今为止,科学家们已针对它发表了500多份研究出版物,但是人cGAS蛋白的结构和关键特征仍然困扰着科学家。
如今,在一项新的研究中,来自美国哈佛医学院和达纳-法伯癌症研究所的研究人员首次鉴定出人cGAS蛋白与其他哺乳动物中的GAS蛋白之间的结构差异和功能差异,并揭示出它在人体中发挥独特功能的结构基础。这项研究概述了人cGAS蛋白的结构特征,这些结构特征解释了人cGAS为何和如何识别某些类型的DNA同时忽略其他类型的DNA。相关研究结果发表在2018年7月12日的Cell期刊上,论文标题为“Structure of the Human cGAS–DNA Complex Reveals Enhanced Control of Immune Surveillance”。
论文通信作者、哈佛医学院/达纳-法伯癌症研究所微生物学与免疫生物学助理教授Philip Kranzusch说,“人cGAS的结构和作用机制一直是免疫学和癌症生物学领域中的一个关键的缺失部分。我们的研究结果详细阐述了人cGAS的分子组成和功能,从而弥补了我们的知识中的这个重要的缺口。”
重要的是,这些研究结果能够为设计适合人cGAS蛋白的独特结构特征的小分子药物提供了信息---这一进展有望改进当前作为抗癌疗法正在开发中的精准cGAS调节药物。
Kranzusch说,“当前正在开发中的几种有前途的实验性免疫疗法是针对小鼠cGAS的结构而被开发出的,它与人cGAS存在着关键的结构差异。我们的发现应该有助于优化这些实验性疗法并促进人们设计出新的疗法。这将为结构导向地设计调节这个基础蛋白活性的药物铺平道路。”
Kranzusch团队的研究结果解释了人cGAS蛋白的一个独特特征---相比于其他动物中的cGAS蛋白,它能够高度选择性地检测某些类型的DNA而且它更不容易被激活。
具体而言,这项研究表明人cGAS携带的突变使得它对长片段DNA非常敏感,但是也让它对短片段DNA“不敏感”。
论文共同第一作者、哈佛医学院微生物学与免疫生物学系博士后研究员Aaron Whiteley说,“人cGAS是一种高度选择性的蛋白,它已进化出更强的DNA特异性。我们的实验揭示出这种能力的基础。”
在所有哺乳动物中,cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作cGAMP的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
论文共同第一作者、哈佛医学院/达纳-法伯癌症研究所博士后研究员Wen Zhou说,“这是一种很好的平衡行为,可确保免疫系统保持平衡。过度活跃的cGAS能够引发自身免疫反应或自我攻击,而未能检测到外来DNA的cGAS能够导致肿瘤生长和癌症进展。”
这项新的研究揭示出这种蛋白结构的进化变化,从而允许人cGAS忽略它遇到的一些DNA,同时对它遇到的其他DNA作出反应。
就这项新的研究而言,这些研究人员的研究对象是霍乱弧菌(Vibrio cholerae)。这种细菌会导致霍乱,也是人类最古老的祸害之一。
利用一种与cGAS具有相似性的霍乱弧菌酶,这些研究人员能够在这种细菌中重建人和小鼠cGAS蛋白的功能。
通过与来自哈佛医学院细菌学家John Mekalanos实验室的同事们合作,这些研究人员设计出一种嵌合或杂合形式的cGAS,它包括来自人类和小鼠cGAS的遗传物质。随后,他们将这种杂合cGAS识别DNA的能力与完整的人cGAS和小鼠cGAS的识别能力进行比较。
在一系列实验中,这些研究人员观察了这些不同类型cGAS之间的激活模式,并逐步缩小导致这三者之间存在不同DNA激活模式的关键差异。
这些实验表明在人类和小鼠cGAS中存在差异的116个氨基酸中,仅两个氨基酸导致人cGAS的功能变化。确实,人cGAS能够高精度地识别长片段DNA,但它会忽略了短片段DNA。相反,小鼠cGAS不能区分长片段DNA和短片段DNA。
Whiteley说,“这两个微小的氨基酸发挥着如此重大的作用。它们让人cGAS具有高度选择性,仅对长片段DNA作出反应,同时忽略短片段DNA,这就使得人cGAS更能耐受DNA在细胞质中的存在。”
通过在进化时间尺度上绘制遗传分歧,这些研究人员确定人类和小鼠cGAS基因在1000万到1500万年前的某个时间分开。
负责检测长片段DNA和耐受短片段DNA的这两个氨基酸仅在人类和非人灵长类动物(比如大猩猩,黑猩猩和倭黑猩猩)中发现到。
这些研究人员猜测忽略短片段DNA但识别长片段DNA的能力必定会带来一些进化上的好处。
Kranzusch说,“这可能是一种阻止过度活跃的免疫系统和慢性炎症的方法。或者这可能是通过不识别短片段DNA来降低患上某些人类疾病的风险。”
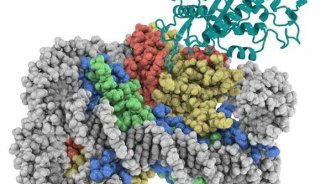
在最后一组实验中,这些研究人员解析出人cGAS的活性形式与DNA结合在一起时的原子结构。
为了做到这一点,他们使用了一种被称作X射线晶体衍射的可视化技术。这种技术能够基于X射线衍射图案揭示出蛋白晶体的分子结构。
分析人cGAS“在发挥作用时”的结构揭示出让它能够选择性地结合长片段DNA同时忽略短片段DNA的精确分子变异。
Kranzusch说,“理解是什么让人cGAS的结构和功能与其他物种cGAS存在的差异正是这个缺失的部分。如今,我们解析出它的结构,我们真地能够开始设计适用于人体而不适用于小鼠的药物。”
-
项目成果
-
项目成果