交界可切除的胰腺癌患者经化疗+放疗+免疫治疗后获得R0..
交界可切除的胰腺癌患者经化疗+放疗+免疫治疗后获得R0切除病例分析
胰腺癌患者预后较差,80%以上的患者确诊时无法行根治性手术,而且术后的复发转移率也很高,因此化疗是目前胰腺癌的主要治疗选择。但现有的标准化疗方案带来的获益有限,仍需寻找新的治疗手段。近年来,免疫治疗已在多个瘤种中取得了令人瞩目的成果,然而,胰腺癌免疫抑制性的肿瘤微环境限制了单纯免疫治疗的效果,针对胰腺癌免疫微环境的联合治疗策略,有望提高胰腺癌免疫治疗的效果,为胰腺癌患者带来新的治疗选择。
病例部分
病例来源:南京大学医学院附属鼓楼医院胰腺肿瘤MDT团队提供
基本病史:
患者男性,63岁。2020年6月12日因“上腹部不适半年余”就诊。既往史:陈旧性肺结核、下肢静脉血栓。体格检查:无明显异常。
辅助检查:
肿瘤标志物:CA19-9:85.06U/ml,CA242:17.77U/mL,余(-)。
血常规、生化全套:无明显异常。
腹部B超(2020-06-02):胰腺体部低回声包块。
腹部增强CT(2020-06-11):胰体部乏血供占位,胰腺癌可能。
治疗前CT(2020-06-15):病灶长径:32mm;侵犯门静脉、肠系膜上静脉及脾静脉;无远处转移。
胰腺穿刺涂片(2020-06-19):查见癌细胞。
胰腺穿刺组织(2020-06-19):凝血块内见极少量异型腺上皮细胞,具有中-重度异型性。
诊断:
胰腺癌(胰体部,交界可切除,合并门静脉、肠系膜上静脉及脾静脉侵犯)
治疗史:
患者于2020-06-23至2020-10-13行AG方案(白蛋白紫杉醇+吉西他滨)化疗联合替雷利珠单抗(百泽安®)治疗4周期。期间于2020-09-07至2020-09-25行胰腺病灶三维适形调强放疗:预防区计划靶区(PTV):2.0Gy×15f;原发肿瘤计划肿瘤靶区(PGTV):2.4Gy×15f。客观疗效评估为部分缓解(PR)。治疗后血清CA19-9降至正常范围。
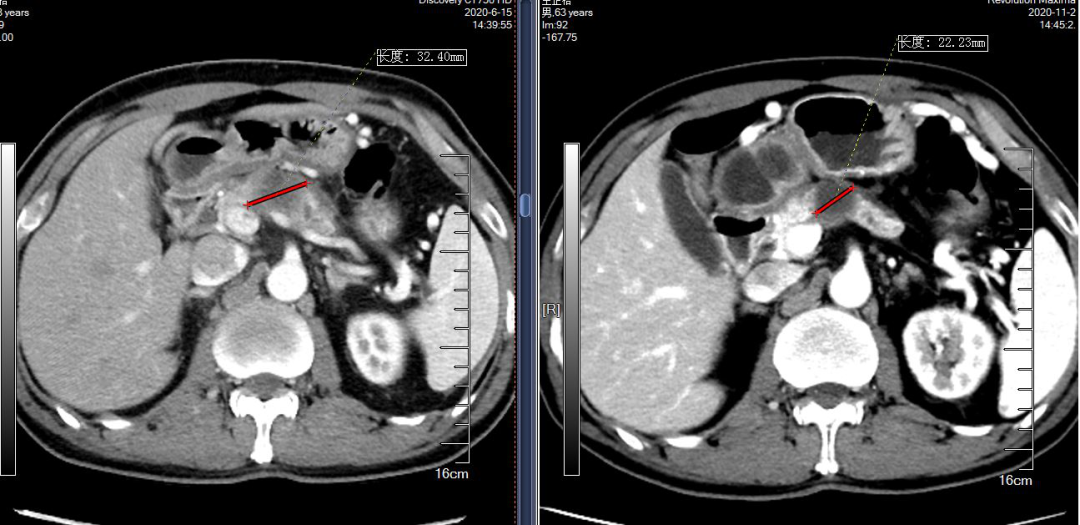
图1 患者病灶治疗前后的CT变化:治疗前肿瘤最大径32mm vs 化疗4周期+放疗1月后肿瘤最大径22mm
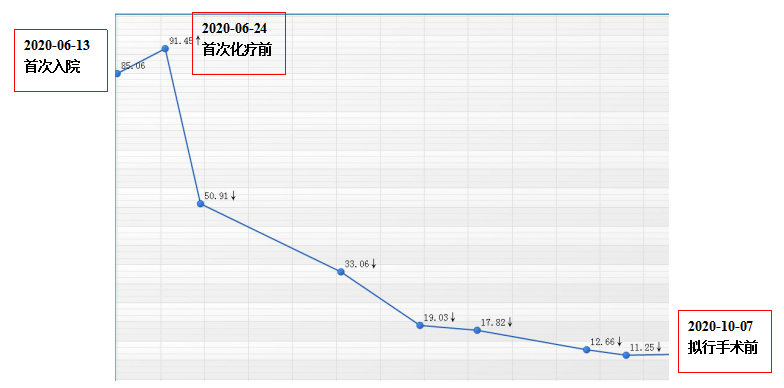
图2 患者治疗期间CA19-9变化趋势
患者于2020-11-10行全胰十二指肠切除+全脾切除+远端胃切除+门静脉-肠系膜上静脉切除+人工血管重建+区域淋巴结廓清+胰周神经切除+营养性空肠造瘘术。
术后病理:(全胰腺、部分胃及十二指肠切除标本):导管腺癌伴中-重度治疗反应,胶原及退变坏死区域约占80%,残余肿瘤细胞多位于病变周边部,CAP评分:2分;Evans分级:2级。神经(+),脉管(-),切缘(-),淋巴结(0/10)。
分期:ⅡA(yT3,N0,cM0)。
免疫组化:癌细胞表达Ki67(40%+),P16(-),CD56(-),PD-1(淋巴细胞10个/HPF),PD-L1(SP142)(癌细胞1%+,间质免疫细胞2%),CD3(淋巴细胞60个/HPF+),CD8(淋巴细胞25个/HPF+)。

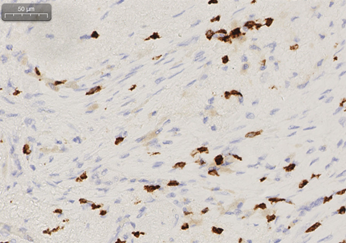
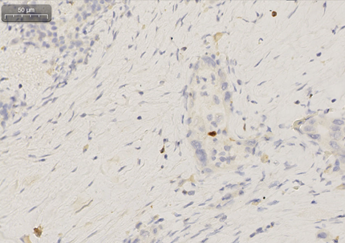
图3 患者术后病理组织免疫组化(CD3、CD8、PD-1)
病例小结:
该患者为胰体部癌,合并门静脉、肠系膜上静脉及脾静脉侵犯,为交界可切除肿瘤。经化疗、放疗联合替雷利珠单抗免疫治疗后,病灶明显缩小,疗效评价达PR,血清CA19-9降至正常。该患者转化治疗有效,遂进行手术,达到R0切除,术后出现胰瘘,无其他不良反应。术后病理示肿瘤坏死率高达80%,CD3、CD8免疫细胞比例高,PD-1表达高,考虑可能与替雷利珠单抗的使用有关。
专家病例点评
对于潜在可切除的胰腺癌,近年来越来越多的证据支持行术前新辅助治疗。已有多项临床研究报道,交界可切除或者局部晚期患者先行新辅助放化疗后再手术,可以提高转化率,增加行根治性手术的机会,提高R0切除率,减少术后肝转移的风险,延长无病生存期和总生存期。2019年美国哈佛大学的一项研究证实,新辅助化疗+放疗可以使局部晚期胰腺癌受试者的R0切除率达到61%。但是NCCN指南中指出,目前关于新辅助治疗的方案尚缺乏大样本的III期临床研究的数据,所以还没有公认的放化疗方案,因此建议在大型临床医学中心积极开展相应的临床研究。
胰腺癌普遍被认为是免疫治疗不敏感的瘤种,对于非错配修复缺陷/微卫星高度不稳定(dMMR/MSI-H)或者非肿瘤突变负荷高(TMB-H)的患者,单用PD-1抗体免疫治疗往往无效。胰腺与十二指肠和胃等空腔脏器毗邻,由于这种解剖结构的特殊性,导致胰腺癌部位无法行大剂量放疗,单纯常规剂量的放疗往往效果不佳。另外胰腺癌丰富的间质又使得化疗药物难以渗透,因此单纯化疗达到PR的也不多。化疗和放疗可以促进肿瘤抗原的释放,改善肿瘤免疫微环境,激活机体免疫反应等,如果将免疫治疗和化疗、放疗等有机组合后则会产生相对较好的结果,在胃癌、肺癌等其它瘤种均已见到相关治疗的报道。
该病例经过化疗联合免疫治疗序贯放疗的新辅助治疗后,病灶缩小达PR,血清肿瘤标记物CA19-9降至正常,之后的手术达到了R0切除。尤其令人感到可喜的是术后病理报告显示肿瘤坏死达到80%以上,更令人感兴趣的是,免疫组化显示CD3、CD8等免疫活性细胞的比例显著增多(与既往未行新辅助治疗的患者的病理相比),考虑这可能是新辅助治疗改善肿瘤微环境,激活免疫反应的一种表现。治疗期间无明显不良反应,患者耐受性良好。这种新辅助治疗的模式值得在胰腺癌的治疗中进一步探索。
总结
胰腺癌也被称为“癌中之王”,中位生存期只有约3-6个月,5年生存期少于5%。化疗仍然是晚期胰腺癌治疗的基石,然而现有标准化疗方案获益有限。免疫治疗为胰腺癌带来了新的希望,但由于胰腺癌免疫抑制性的肿瘤微环境,限制了单纯免疫治疗的效果。近年来研究发现,免疫治疗联合化疗具有协同效应,较单一化疗方案可显著延长患者OS,并且免疫治疗联合放疗也显示出初步疗效。本例患者接受替雷利珠单抗免疫治疗、联合化疗序贯放疗的新辅助治疗后,病灶缩小,手术达到R0切除,疗效喜人。
替雷利珠单抗是由百济神州自主研发的针对PD-1的人源化单克隆抗体,结构上对Fc段进行了独特改造,去除了自身与巨噬细胞表面FcγR结合的能力,避免了抗体决定的细胞吞噬(ADCP)效应导致的T细胞消耗。其Fab段与PD-1的亲和力高于同类抗体,发挥强大阻断作用。目前,替雷利珠单抗已获批用于复发/难治经典型霍奇金淋巴瘤和局部晚期或转移性尿路上皮癌,其在胰腺癌中的应用前景值得关注。
-
焦点事件













