基因人源化动物模型应用与构建
古代祖先神农尝百草为治病救人,根本原因在于缺乏人类试药的替身,只能以身试法。上一期我们介绍了一种“目前最接近人类临床实际情况的肿瘤模型”——“PDX”人源化动物模型,今天我们继续为大家介绍另一种十分重要的人源化动物模型——基因人源化模型。
人源化动物模型(Humanized Animal Model )
指携带有人源的功能性基因、细胞、组织或者器官的动物模型,是目前常用的最接近人类的疾病研究动物模型。前几期我们已经介绍了人源细胞及组织的移植模型,本期着重介绍基因人源化的动物模型。
基因人源化动物模型 利用转基因或同源重组的方法,将人源基因放在动物基因组内,在动物体内表达人源的基因,动物自身基因不再表达。
为什么进行基因人源化呢?
小鼠与人类基因组虽具有高度同源性,但是很少有功能性基因在人鼠上具有100%的保守性,这种差异很可能会导致动物和人体结果的出入。如以下例子可以说明:
举例1:如在药物代谢中,利福平不能诱导小鼠肝脏中的CYP3A的表达,而将小鼠的PXR基因人源化之后,利福平表现出对小鼠肝脏CYP3A的强诱导作用。可见模型动物的人源化能在一定程度上,克服基因差异造成的种属差异(下图)[1]。

PXR的人源化能显著增强利福平(RIF)对小鼠肝脏CYP3A的诱导作用
举例2:又如在肿瘤免疫治疗中,小鼠的免疫检查点基因与人类对比,在蛋白氨基酸序列上相似性仅约60%。因此若选择小鼠来检测抗人蛋白抗体的药效,抗体很可能不识别小鼠相应蛋白。这就需要将小鼠的免疫检查点基因进行人源化改造,因此hPD-1小鼠应运而生。
举例3:如在病毒感染中,表达野生型CD81和OCLN(occludin)的小鼠对HCV(HepatitisC Virus)不敏感,而在小鼠体内表达这两个基因的人源同源基因之后,小鼠便会受到HCV的感染[2]。
人源化动物模型应用
基因人源化动物模型大大提高了模拟人类某些疾病的有效性,目前应用很广泛,如下:
①人类基因的功能研究,解码人类疾病奥秘;
②肿瘤免疫治疗研究,如h-PD-1小鼠;
③临床前药物评价:药效,药物代谢研究等;
④ 疾病研究:癌症、传染病、血液病研究等;
⑤组织或者器官供体动物的制备等。
下面看看,基因人源化模型是如何构建的呢?
基本原理:运用DNA定点同源重组的原理,将人源的基因的部分片段(如重要结构域、编码区等)或者基因全长(如所有外显子和内含子、启动子区域、3’和5’-UTR等)定点整合到实验动物特定的基因位点,进而达到替换掉实验动物的该基因的目的。如下图所示:

人源化动物模型构建示意图
目前应用较多的是利用ES细胞同源重组技术和CRISPR/Cas9显微共注射技术构建基因人源化动物模型。但由于ES细胞培养和操作的物种限制和得到纯合人源化动物的周期也相对较长,因此该方法具有一定局限性。
CRISPR/Cas9是利用显微共注射直接将CRISPR/Cas9系统和同源重组质粒注射进动物的受精卵,不需要培养和操作ES细胞,得到纯合人源化动物的周期也相对较短,但缺少了体外筛选的过程,获得阳性子代的概率就相对较小。
构建注意事项
基因人源化的本质即基因大片段敲入,构建过程在之前的KI文章描述过,不再赘述。需要注意的是:构建基因人源化动物模型的关键在于提高人源基因同源重组效率,目前有以下几个方向:
①优化同源重组载体同源臂的长度;
②在Cas9上融合表达能提高同源重组的蛋白;
③抑制非同源重组末端连接的发生;
④ES细胞的体外筛选,可以提高阳性子代的获得率,所以开发更多物种的ES细胞的培养和操作方法也能间接提高同源重组的成功率。
下面以2个较常用的模型为例,为大家详细讲解:
一、人源化药物代谢动物模型
药物的吸收、分布、代谢以及消除(ADME)影响着药物在人体内的有效性和安全性,其中人体的几类蛋白扮演着重要角色,然而它们却在人鼠之间却存在很大差异。
①如几个主要参与药物代谢的CYP450酶,其人鼠之间基因序列的相似性大都75%左右,其中最重要CYP3A,人鼠间序列的相似性不足70%[3];
②且人鼠间CYP450酶的亚型分布也有较大差异;人CYP2C的亚型仅有CYP2C8、CYP2C9、CYP2C18、CYP2C19四个亚型,但大鼠和小鼠中分别有七个和九个CYP2C亚型[3];
③对于异型生物质受体,不同物种间的同源受体可能对同一物质具有不同的敏感性。如上文提到的人源的PXR对RIF敏感,而鼠源的PXR对PCN敏感[1]。
因此,普通小鼠上进行的药物评价是仅仅不够的,将这些关键基因在动物上进行人源化,建立基因结构、表达谱和调节方式与人类相似的模型,才是解决种属差异的有效途径之一。
目前国际上已有一些人类药物相关基因人源化小鼠,比如CYP3A4人源化小鼠,PXR-CAR双基因人源化小鼠,AHR人源化小鼠等。近几年来,由于CRISPR/Cas9基因组编辑技术的成熟,使大鼠的人源化成为可能。
我国已经建立了一些药物代谢基因的大鼠模型,如Abcb1、AHR人源化大鼠模型。
下面以Cyp3a4/Cyp3a7/PXR/CAR多基因人源化小鼠模型构建为例:
CYP3A4(Cytochrome P450 3A4)是人肝肠中主要表达的一个Ⅰ相药物代谢酶,参与了约50%的临床药物的代谢。但人和小鼠之间的Cyp3a基因具有较大种属差异,使得候选化合物在小鼠的代谢情况与人的代谢情况存在一定差异。
另外,PXR(Pregnane X Receptor)和CAR(Constitutive Androstane Receptor)是Cyp450上游的调节基因,能参与到Cyp3a4等亚型的诱导表达。PXR、CAR具有的人鼠差异也会影响小鼠模型对化合物的代谢研究结果在人上的可适用性。
如下图为:Cyp3a4/Cyp3a7/PXR/CAR多基因人源化模型的构建过程

Cyp3a4/Cyp3a7/PXR/CAR人源化小鼠模型构建 [4]
具体可简述为如下步骤 [4]:
1、为敲除小鼠Cyp3a57-Cyp3a25基因簇,分别构建包含筛选标记和loxP等位点的靶向小鼠Cyp3a57和Cyp3a59的打靶载体(如上图A-C所示);
2、将1中打靶载体转入小鼠ES细胞,针对Cyp3a57-Cyp3a25基因簇的5’和3’端,通过同源重组引入两个同向loxP位点(如上图D所示);
3、通过在小鼠ES细胞中转染Cre质粒实现由Cre-loxP介导的Cyp3a57-Cyp3a25基因簇的缺失(如上图E所示);
4、构建含loxP位点和人源Cyp3a4/Cyp3a7基因片段的打靶载体(如上图F所示);
5、将4中打靶载体转入3中ES细胞,通过Cre-loxP介导的不同DNA链间的染色体易位实现人源Cyp3a4/Cyp3a7基因的定点整合(如上图G、H所示);
6、体外编辑好的ES细胞经囊胚注射、嵌合鼠繁殖,背景纯化,最终获得纯合子Cyp3a4/Cyp3a7人源化小鼠;
7、将Cyp3a4/Cyp3a7人源化小鼠和PXR、CAR人源化小鼠进行杂交,即可获得Cyp3a4/Cyp3a7/PXR/CAR人源化小鼠。
构建时需要注意的事项
对于多基因人源化,若两个基因不在同一条染色体上,一般先分别进行打靶,然后再将单个基因人源化小鼠进行交配,得到多基因人源化小鼠。在这个过程中,一定要验证每一个单基因人源化小鼠是正确而有功能的。由于Cyp450基因亚型众多,这给Cyp450全基因敲除和人源化带来了一定难度。
数据分析:如下图所示,研究人员通过构建Cyp3a4/Cyp3a7/PXR/CAR多基因人源化小鼠模型,观察到了RIF,磺吡酮(SUL)以及吡格列酮(PIO)成功通过人源PXR诱导人源CYP3A4的表达,在一定程度上克服了种属差异[4]。
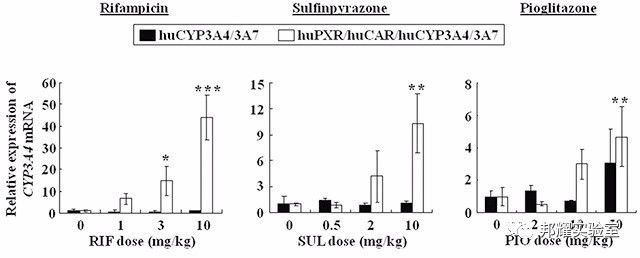
Cyp3a4/ Cyp3a7/PXR/CAR人源化小鼠对药物具有和人相似的敏感性[4]
二、 PD-1人源化小鼠
肿瘤免疫疗法是当前肿瘤治疗领域中最具前景的研究方向之一,特别是T细胞免疫检查点抗体成为了肿瘤治疗的有力主角,包括PD-1、PD-L1和CTLA4等。
PD-1,即程序性死亡受体1,是一种重要的免疫抑制分子,PD-1抑制剂是目前非常活跃的一个肿瘤免疫治疗药物。如下为PD-1抑制剂作用原理:
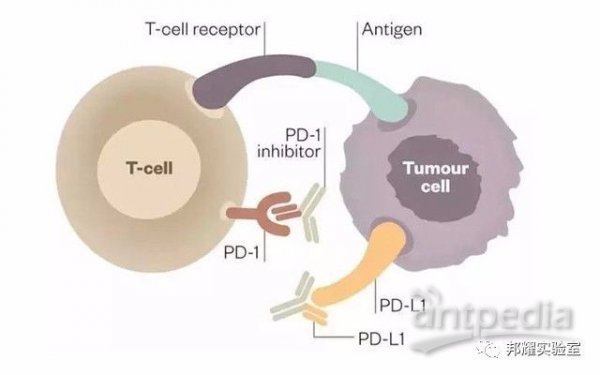
PD-1抑制剂作用原理图(图片来自网络)
但是,该疗法要求实验动物须具备正常的免疫系统,同时,表达人类免疫检查点分子。因此需要对动物的PD-1进行人源化,即将小鼠的PD-1基因换成人的对应部分,才可更为精准地评价PD-1抗体药物在人体内的作用。
PD-1人源化小鼠的构建过程可简述为如下步骤 [5]:
1、构建包含人源PD-1基因胞外蛋白对应序列(包括第二个外显子的全部序列和第三个外显子的部分序列)的打靶载体;
2、将打靶载体转入小鼠ES细胞,经筛选标记筛选出正确整合的ES细胞;
3、将整合正确的ES细胞注射进八细胞期小鼠胚胎,得到嵌合体子代;
4、嵌合体子代与C57BL/6N进行杂交,经背景纯化最终得到纯合的PD-1人源化小鼠模型。
如下图所示:人源化PD-1小鼠可用于PD1抑制剂的评价:

PD-1抗体REGN2810能显著性增加人源化小鼠的生存率[5]
生命医学的研究离不开动物实验,然而实验动物和人之间的种属差异是客观存在的。因此,人源化动物的研究必定是生命医学研究中十分重要的一环。
目前,在这个领域还存在许多需要攻克的困难和需要思考的问题,比如人源化动物模型构建技术的改良及新技术的发明,模型构建成本的控制,以及随着人源化动物越来越“像人”所带来的一系列伦理问题等。
当然,动物实验中最基本的一个伦理问题就是动物福利,实验动物是人类的受难者,是人类实验的替代品,在进行动物实验时请务必善待你的实验动物。
致谢:感谢陈曦同学在基因编辑技术理论方面提供的帮助!
参考资料:
[1] Ma, X. et al. The PREgnane X receptor gene-humanized mouse: a model for investigating drug-drug interactions mediated by cytochromes P450 3A. Drug Metab. Dispos. 35, 194-200, doi:10.1124/dmd.106.012831 (2007).
[2] Ding, Q. et al. Mice Expressing Minimally Humanized CD81 and Occludin Genes Support Hepatitis C Virus Uptake In Vivo. J. Virol. 91, doi:10.1128/JVI.01799-16 (2017).
[3] Martignoni, M., Groothuis, G. M. & de Kanter, R. Species differences between mouse, rat, dog, monkey and human CYP-mediated drug metabolism, inhibition and induction. Expert Opin. Drug Metab. Toxicol. 2, 875-894, doi:10.1517/17425255.2.6.875 (2006).
[4] Hasegawa, M. et al. Quantitative prediction of human pregnane X receptor and cytochrome P450 3A4 mediated drug-drug interaction in a novel multiple humanized mouse line. Mol. Pharmacol. 80, 518-528, doi:10.1124/mol.111.071845 (2011).
[5] Burova, E. et al. Characterization of the Anti-PD-1 Antibody REGN2810 and Its Antitumor Activity in Human PD-1 Knock-In Mice. Mol. Cancer Ther. 16, 861-870, doi:10.1158/1535-7163.MCT-16-0665 (2017).