“女娲”教授石枫:轴手性芳基吡咯并吲哚骨架的设计与构建
导语:基于吲哚的轴手性骨架是一类性质独特的手性杂环骨架,所以催化不对称构建该类骨架已经成为一个重要的研究领域。然而,该领域的研究仍处于起步阶段,面临着一系列挑战性问题,例如:设计与构建新型基于吲哚的轴手性骨架、探索该类骨架在手性催化剂和配体等方面的应用。近日,江苏师范大学石枫课题组设计了一类新型的基于吲哚的轴手性骨架——芳基吡咯并吲哚骨架,并且通过有机催化下3-芳基吲哚平台分子与炔丙醇的不对称(2 + 3)环化反应的策略,实现了该类骨架的对映选择性构建。更重要的是,该类新型轴手性骨架衍生的三级膦,在钯催化的不对称反应中能够作为高效的手性配体。此外,通过理论计算,实现了对反应机理和活化模式的深入理解。该工作为构建基于吲哚的轴手性骨架提供了新策略,有望在不对称催化中发现更多的应用。相关论文发表于Fundamental Research。
轴手性二芳基骨架是一类重要的手性结构单元,不仅广泛存在于天然产物、药物活性分子以及功能材料中,而且被应用于手性配体和手性催化剂中。所以,催化不对称构建轴手性骨架引起了化学工作者们的强烈关注。目前,该领域发展尤为迅速的是轴手性六元(杂)芳基骨架的构建,例如:轴手性联萘、联苯和1-芳基异喹啉骨架。与之相比,轴手性五元杂芳基骨架的催化不对称构建却发展缓慢,主要是由于此类骨架存在邻位基团距离较远、旋转能垒较低、构型稳定性较差等挑战性问题(图1a)。因此,催化不对称构建轴手性五元杂芳基骨架的探索依然是任重而道远。
吲哚是一类重要的五元杂芳环,不仅具有较高的富电性和芳香性,而且含有NH基团(图1b)。吲哚的结构特点可以为轴手性吲哚骨架带来一些独特的性质,如改变电子云密度、调节空间位阻、实现后官能团化和作为氢键给体等。因此,近年来,催化不对称构建基于吲哚的轴手性骨架发展为一个新兴的研究领域,化学工作者构建了一系列新颖的轴手性吲哚骨架,例如:轴手性N-芳基吲哚、3-芳基吲哚、2-芳基吲哚以及双吲哚骨架等(图1c)。尽管如此,该领域仍然处于起步阶段,存在一些亟待解决的问题,例如:(1)设计与构建基于吲哚的新型轴手性骨架;(2)开发相关轴手性骨架在手性配体、手性药物、手性材料等领域的应用。

图1. 催化不对称构建轴手性二芳基骨架的研究概况
在目前已构建的轴手性吲哚骨架中,3-芳基吲哚骨架由于在手性膦催化剂和生物活性分子中的应用(图2a),该类骨架的构建具有重要意义,而不对称有机催化被认为是构建轴手性骨架的一种强有力方法。目前,不对称有机催化下构建轴手性3-芳基吲哚骨架的代表性策略主要有三种(图2b)。第一种策略是手性磷酸(CPA)催化下吲哚环与芳环的直接偶联策略,主要包括石枫课题组发展的2-吲哚甲醇与2-萘酚的偶联反应(Eq. 1, Angew. Chem. Int. Ed. 2017, 56, 116)、南方科技大学谭斌课题组发展的2-取代吲哚与偶氮萘或亚硝基萘的偶联反应(Eq. 2, Nat. Chem. 2018, 10, 58; Chem 2020, 6, 2046);第二种策略是有机催化下原位构建吲哚环的策略,主要包括谭斌课题组发展的CPA催化下2-取代吲哚与偶氮萘或亚硝基萘的重排反应(Eq. 3, Nat. Chem. 2018, 10, 58; Chem 2020, 6, 2046)、新加坡国立大学赵宇课题组发展的手性氮杂卡宾(NHC*)催化下炔丙醇与烯醛的串联反应(Eq. 4, J. Am. Chem. Soc. 2019, 141, 17062);第三种策略是CPA催化下外消旋3-芳基吲哚的亲核加成反应,主要是石枫课题组发展的3-芳基吲哚平台分子与偶氮二羧酸酯或邻羟基苄醇的加成反应(Eq. 5, Angew. Chem. Int. Ed. 2019, 58, 15104)。尽管有了这些报道,催化不对称构建该类骨架的策略仍然非常有限。所以,迫切需要发展新策略,以实现基于3-芳基吲哚的轴手性骨架的设计与构建。

图2. 有机小分子催化不对称构建轴手性3-芳基吲哚骨架的研究概况
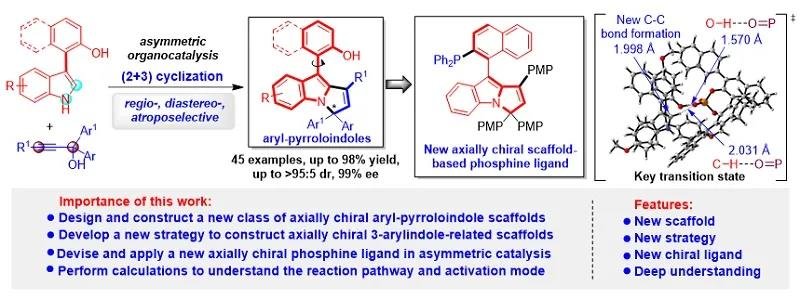
为了实现上述目标,石枫课题组基于对手性吲哚化学的理解(For a summary: Acc. Chem. Res. 2020, 53, 425),提出了基于3-芳基吲哚平台分子参与的催化不对称(2 + n)环化反应的策略,用于构建新型的轴手性3-芳基吲哚稠环骨架。在该策略中,吲哚的C2-位和NH基团作为亲核位点,使3-芳基吲哚平台分子作为1,2-双亲核试剂,在手性布朗斯特酸(B*-H)催化下与合适的双亲电试剂(E1-E2)发生(2 + n)环化反应(图3a)。由于新形成的环系与OH基团之间的空间位阻,可以实现新型轴手性3-芳基吲哚稠环骨架的构建。该策略的独特优势是:能够形成新的环系、构建新型的轴手性骨架、产生多重手性元素。然而,采用该策略仍然需要克服一些挑战,主要包括:(1)寻找到合适的能够被B*-H活化的双亲电试剂,以实现其与3-芳基吲哚的(2 + n)环化反应;(2)由于两种反应底物中均存在两个竞争的反应位点,所以需要控制好(2 + n)环化反应的区域选择性和对映选择性;(3)当采用外消旋的双亲电试剂参与(2 + n)环化反应时,需要同时控制好所构建骨架的轴手性和中心手性。
为了解决这些挑战性问题,作者设想:对羟基苯基或对烷氧基苯基取代的炔丙醇或许可以作为一类合适的双亲电试剂,参与所设计的(2 + n)环化反应。该设想是基于香港科技大学孙建伟课题组的首次报道(Nat. Commun. 2017, 8, 567):该类炔丙醇在B*-H催化下,可以脱水生成对亚甲基苯醌中间体(p-QMs),从而与亲核试剂发生1,8-加成反应生成轴手性联烯(图3b)。
所以,在该工作的设计中(图3c),作者设想此类炔丙醇可以作为合适的1,3-双亲电试剂,在CPA催化下与3-芳基吲哚发生对映选择性的(2 + 3)环化反应,从而构建新型的轴手性芳基吡咯并吲哚骨架。该反应将通过动态动力学拆分(DKR),先发生1,8-加成反应,产生手性联烯中间体,再经历质子化和分子内环化过程,生成轴手性芳基吡咯并吲哚。在反应过程中,CPA可以依次活化3-芳基吲哚的OH和NH基团,从而控制(2 + 3)环化反应的区域选择性。此外,CPA与底物和中间体之间的相互作用,将促进DKR过程和立体选择性的分子内环化,从而控制所构建的芳基吡咯并吲哚骨架的轴手性和中心手性。因此,所设计的(2 + 3)环化反应将为构建基于吲哚的新型轴手性骨架提供新策略,并且可以同时控制多重手性元素。
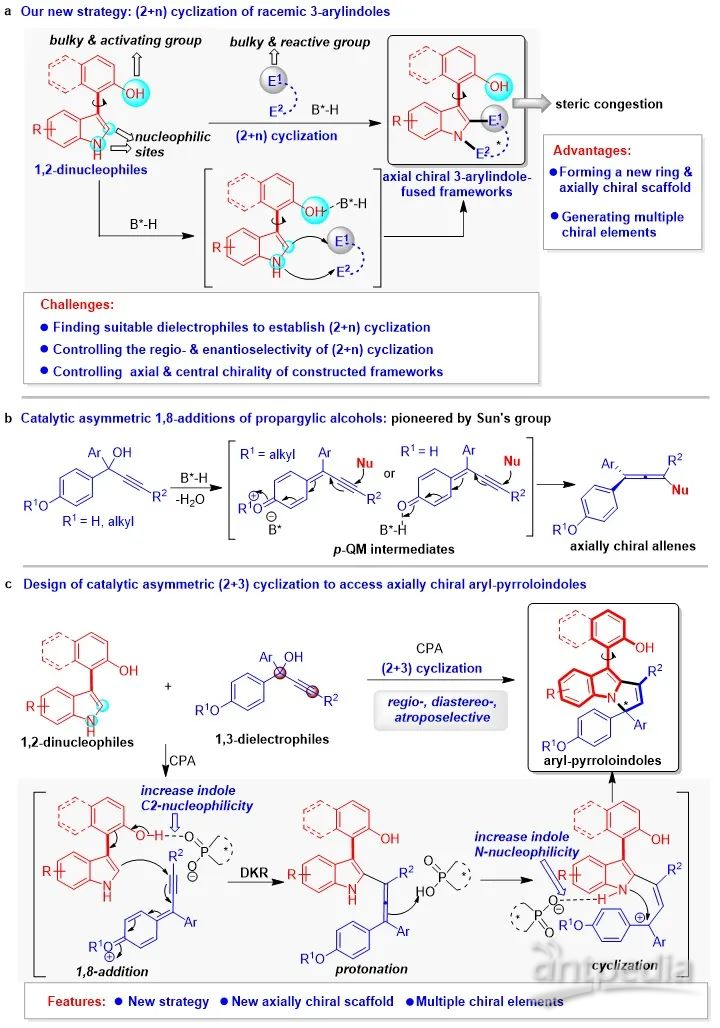
图3. 设计构建新型轴手性3-芳基吲哚稠环骨架的策略
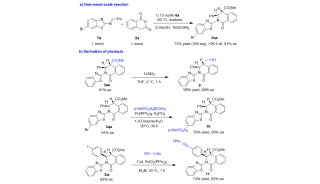
基于上述构建策略的设计,石枫课题组成功地实现了新型轴手性芳基吡咯并吲哚骨架的催化不对称构建,高收率(up to 97% yield)、高对映选择性(up to 98% ee)地获得了结构多样的轴手性芳基吡咯并吲哚化合物3(图4)。
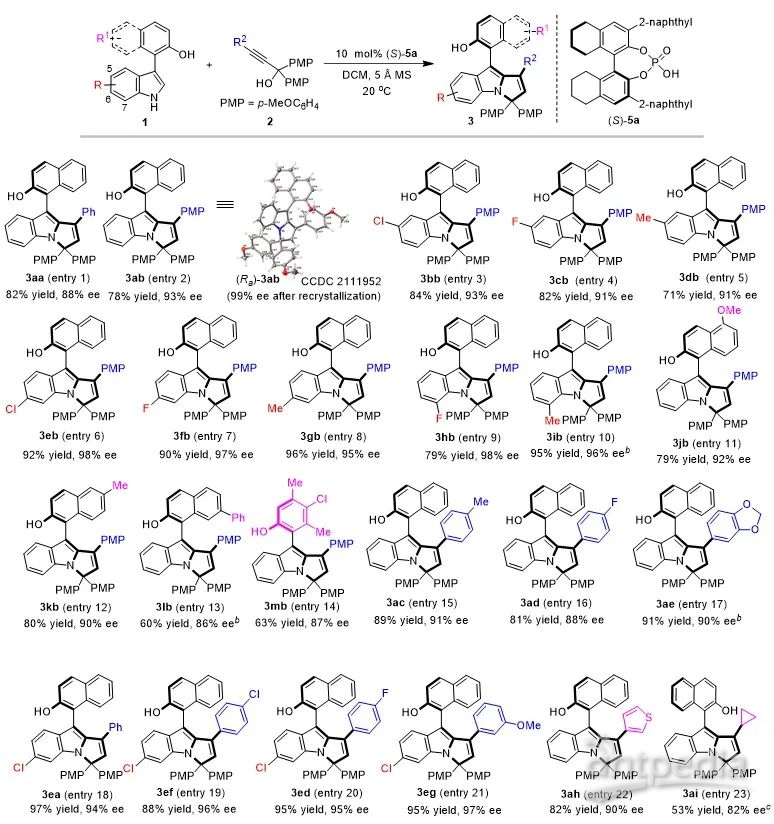
图4. 轴手性芳基吡咯并吲哚骨架的构建
此外,该课题组还进一步探索了兼具轴手性和中心手性的芳基吡咯并吲哚骨架的催化不对称构建。该类骨架由于具有多重手性元素,所以其立体选择性控制更具挑战性。作者通过一系列尝试,最终以中等到优秀的收率(56-98% yield)、优秀的非对映选择性和对映选择性(up to >95:5 dr, 99% ee),获得了一系列新型的兼具轴手性和中心手性的芳基吡咯并吲哚化合物7(图5)。
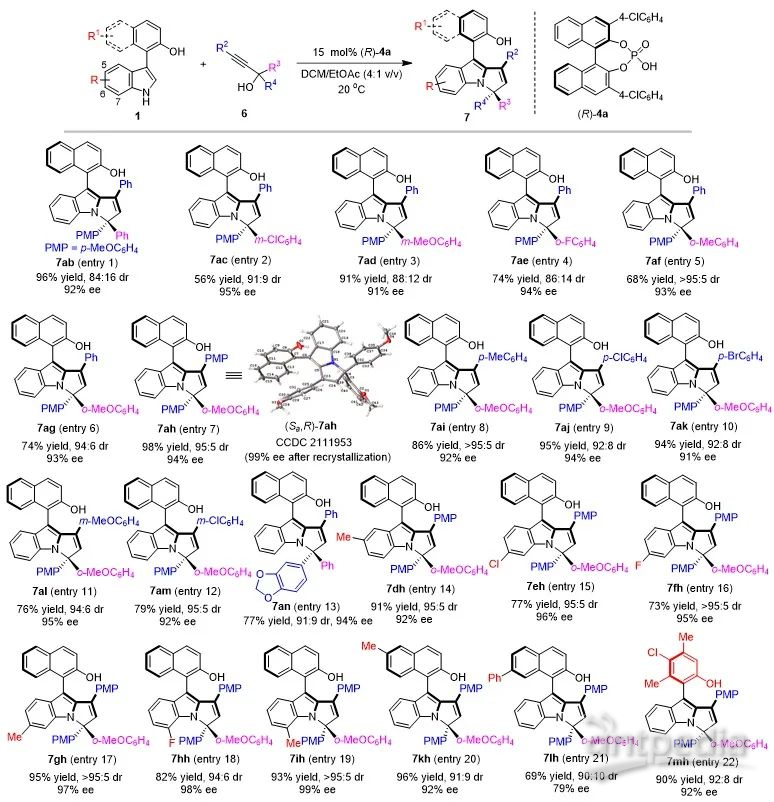
图5. 兼具轴手性和中心手性的芳基吡咯并吲哚骨架的构建
为了探究该类新型轴手性芳基吡咯并吲哚骨架的潜在应用价值,作者对产物进行了合成转化以及尝试其在不对称催化中的应用(图6)。首先,1 mmol规模的实验结果,说明了该催化不对称(2 + 3)环化反应可用于放大量合成(图6a)。其次,轴手性芳基吡咯并吲哚化合物通过衍生化,可以转化为新型的单膦配体(图6b)。更重要的是,该类轴手性单膦配体成功地应用于苯乙烯的催化不对称硅氢化反应和Pd(II)催化的不对称烯丙基烷基化反应(图6c)。这些结果表明,该类新型的轴手性芳基吡咯并吲哚骨架可用于开发新型的手性配体和催化剂,有望在不对称催化中发现更多的应用。

图6. 产物的合成转化及其在不对称催化中的应用
为了深化对该类新型轴手性骨架和催化不对称(2 + 3)环化反应的理解,作者探究了该类骨架的稳定性,并进行了控制实验(图7)。实验显示,该类轴手性骨架具有高的稳定性和旋转能垒(图7a)。此外,作者还研究了3-芳基吲哚1中OH基团以及炔丙醇2和6中OMe基团的作用(图7b)。控制实验的结果表明:(1)3-芳基吲哚1中的OH基团很可能与CPA形成了氢键,从而在控制反应的立体选择性方面起着至关重要作用;(2)炔丙醇2和6中的OMe基团有助于其生成p-QM阳离子中间体,并与CPA形成离子对,从而在控制反应性和对映选择性方面发挥着重要作用。
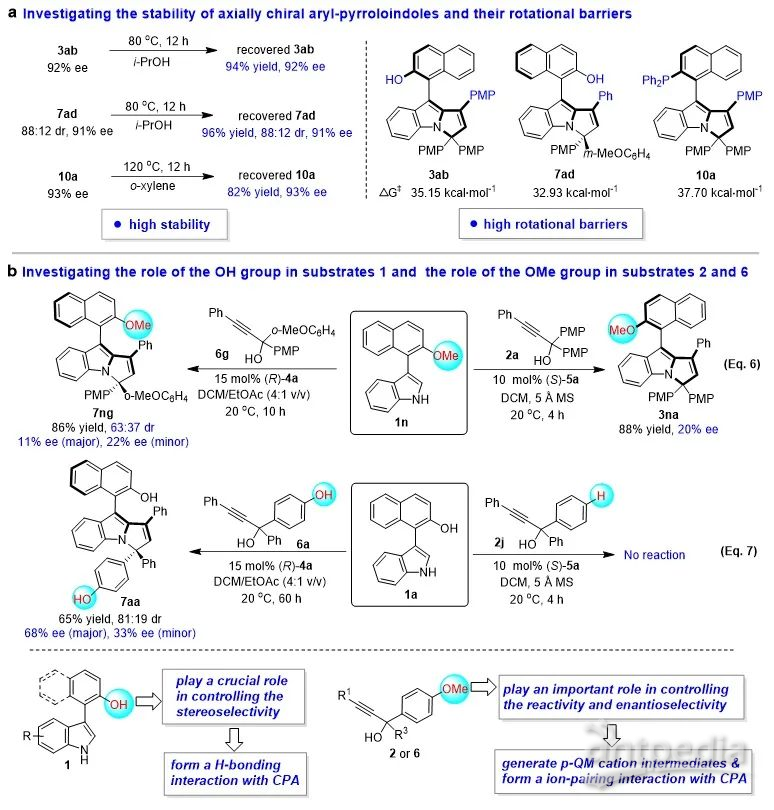
图7. 探究轴手性芳基吡咯并吲哚骨架的稳定性及控制实验
为了深入理解这一反应,石枫课题组与湖南科技大学焦银春课题组进行合作,对合成产物(Ra)-3ab的可能反应路径和活化模式进行了理论计算(图8)。首先,计算出底物1a的旋转能垒为19.79 kcal mol-1(图8a),远低于可分离出阻旋异构体所需的24 kcal mol-1,这说明(Ra)-1a在室温下很容易转化为(Sa)-1a,从而有利于后续的DKR过程。同时,计算表明,炔丙醇2b在CPA (S)-5a的催化下容易脱水,经过过渡态TS-1生成p-QM阳离子中间体INT-1(图8b)。随后,作者详细计算了可能的反应路径和活化模式(图8c),并且归纳了反应过程的自由能垒图(图8d)。值得注意的是,在反应的关键过渡态TS-2中,催化剂(S)-5a不仅与底物(Sa)-1a的OH基团和CH基团同时形成两个氢键,而且与p-QM阳离子产生离子对作用,从而促进它们之间的1,8-加成反应。然而,在TS-2’中,由于底物(Ra)-1a的OH基团距离催化剂(S)-5a较远,使(S)-5a只能与(Ra)-1a的CH基团形成氢键,并不能与(Ra)-1a的OH基团形成氢键,导致底物(Ra)-1a比(Sa)-1a难以进行1,8-加成反应。所以,TS-2与TS-2’中底物与催化剂之间的不同活化模式导致了它们能垒的差异 (3.05 kcal mol-1),从而解释了反应的DKR过程和高对映选择性生成(Ra)-3ab的原因。
 图8. 通过理论计算探究可能的反应路径和活化模式
图8. 通过理论计算探究可能的反应路径和活化模式
综上所述,江苏师范大学石枫课题组通过有机催化不对称(2 + 3)环化反应的策略,实现了新型轴手性芳基吡咯并吲哚骨架的设计及对映选择性构建。该策略通过手性磷酸催化下3-芳基吲哚平台分子的动态动力学拆分,高收率(up to 98% yield)、高立体选择性(up to >95:5 dr, 99% ee)地获得了兼具轴手性和中心手性的芳基吡咯并吲哚化合物。更重要的是,这种新型的轴手性骨架具有很高的稳定性,可以衍生为新型的膦配体,应用于钯催化的不对称反应。此外,通过理论计算,深化了对反应机理和活化模式的理解。该工作不仅为轴手性家族增添了芳基吡咯并吲哚这一新成员,而且为设计和构建基于3-芳基吲哚的轴手性骨架提供了新策略。该类轴手性骨架有望被开发为新型手性配体或催化剂,在不对称催化中得到更多的应用。
上述研究成果作为特邀稿件发表在Fundamental Research。《Fundamental Research》是由国家自然科学基金委员会主管、主办的英文学术期刊,于2021年1月创刊(CN 10-1722/N)。期刊立足展示国家自然科学基金资助的代表性成果,充分反映国内外基础研究前沿与动态,促进国际学术交流,提升中国基础研究在国际科学界的显示度和影响力。作为反映世界、特别是中国基础研究最高水平的综合性英文学术期刊,将为科学家打造一个高端的基础研究国际交流平台。期刊内容涵盖数学与物理、化学与化工、生命、地球、工程与材料、信息、管理、健康与医学、交叉科学等九大科学领域。
江苏师范大学硕士研究生伍平为第一作者,实验部分由石枫教授和谭伟副教授共同指导完成,理论计算部分由石枫教授和焦银春副教授共同指导完成。该项工作主要得到了国家自然科学基金和江苏省自然科学基金的资助。