免疫治疗相关的人源化动物模型
昨日,美国FDA批准了全球第二个CAR-T上市,用于治疗特定非霍奇金淋巴瘤,这是继诺华的首个CAR-T疗法的又一次重大突破。肿瘤免疫疗法频传捷报,特别是以嵌合抗原受体T细胞技术(CAR-T)以及免疫检查点阻断技术为代表的新兴肿瘤免疫疗法,发挥着巨大潜力。考虑到该疗法临床前评估需要接近人类免疫系统且具备不用于普通抗癌药物的评价方式,本期我们就特别为大家介绍,这些炙手可热的免疫疗法中,需要用到的人源化动物模型。
肿瘤免疫疗法为什么需要人源化动物?
肿瘤免疫疗法是通过调节机体的免疫防御机制来发挥抗肿瘤效应,需要建立在免疫系统基础上,但是哺乳动物的免疫系统均具有物种特异性。因此,需要具备接近人类免疫系统的动物模型进行临床前治疗效果及安全性评估。
最早,利用进化地位较接近于人的猩猩作为研究模型,但这一做法在欧洲和美国相应被禁止。后来,出现了啮齿类动物人源化,尤其是人源化小鼠,它能精确地模拟人的生物学系统,为人类的生物学研究提供了新了动物模型的选择。
什么是人源化小鼠?
携带人源细胞、组织或者基因的动物模型,与免疫治疗相关的人源小鼠即移植免疫相关的人源细胞或者人源基因的动物模型。
如在NRG、NSG等免疫缺陷小鼠体内经移植人造血干细胞(HSCs)和外周血单核细胞(PBMCs)后可体内研究人的生物学过程一类小鼠。又如敲入人类基因的小鼠,主要是以免疫检查点阻断技术的人源化小鼠如hPD-1,hCTLA-4。
因在肿瘤免疫治疗中发挥着不可忽视的作用,人源化小鼠也就成为了临床前人类生物医学研究的“明星鼠”
因此,免疫治疗中的人源化小鼠主要分为2类:免疫系统缺陷小鼠和表达人源基因的小鼠。下面就具体看看这2类小鼠构建过程及其在肿瘤免疫治疗中的应用。
一、免疫缺陷小鼠
免疫缺陷小鼠是指由于先天遗传突变或用人工方法造成一种或多种免疫系统组成成分缺陷的动物。这类小鼠由于免疫系统缺陷,可适用于人源细胞或组织异种移植,而不产生或者产生较低的免疫排斥,广泛用于临床前的生物医学的研究,因此被称为人源化小鼠。
目前,常见的免疫缺陷鼠有裸鼠,SCID,NOD/SCID,NRG或NSG小鼠。其中NRG,NSG小鼠均是由于无成熟T细胞、B细胞和功能性NK细胞,细胞因子信号传递能力缺失等特点,成为世界上公认的重度免疫缺陷小鼠。下面重点为大家讲述这类小鼠的构建过程及应用。
NRG,NSG小鼠
1. NRG, NSG小鼠的构建
这2种小鼠一般利用CRISPR/Cas9 技术,在NOD小鼠的背景下进行相应基因敲除。
(1)NRG(Rag2-/-, IL-2rg-/-)小鼠:将Rag2,IL-2rg双敲除[1]
①Rag2:在5`UTR和3`UTR上分别设计一个sgRNA,将1号外显子敲除;
②IL-2rg:在1号和7号外显子上各设计一个sgRNA,将2-6号外显子敲除;
③经过显微注射sgRNA后,可以得到NRG小
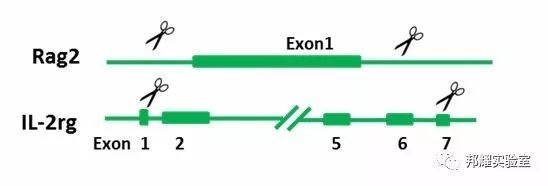
(2)NSG(Prkdc-/-,IL-2rg-/-)小鼠:Prkdc,IL-2rg 双敲除
①IL-2rg:敲除方式同NRG小鼠设计方案;
② Prkdc:可在5`UTR和第5号外显子上分别设计一个sgRNA,将1-4号外显子敲除;
③经过显微注射sgRNA后,可以得到NSG小鼠。NSG也可以通过NOD/SCID 与IL-2rg-/-小鼠交配获得。

2. NRG,NSG小鼠的在免疫治疗中的应用
在免疫治疗中,一般需要重建人类免疫系统才可更准确进行药效评价。由于该类小鼠重度免疫缺陷,可将来源于病人的组织或细胞移植到小鼠身上。如将人的造血干细胞及T细胞通过尾静脉移植到NRG或NSG小鼠。
①由于NRG,NSG小鼠均能支持较高水平的人造血干细胞,外周血及T细胞的移植,因此,NRG 或NSG小鼠广泛用于血液系统疾病,自身免疫疾病的研究[2]。
②其中,经移植人造血干细胞(HSCs),外周血单核细胞(PBMCs)到NRG或NSG小鼠后可得到重建人的免疫系统的小鼠为体内研究人类感染性疾病,自身免疫,肿瘤发生发展,再生医学,免疫治疗等生物学进程提供可能[3]。如图-1所示:
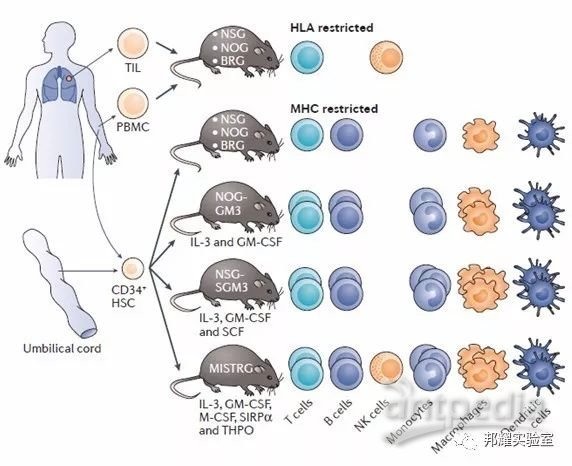
图-1 在NSG等免疫缺陷小鼠上重建人类免疫系统
③结合当前领域中炙手可热的 CAR-T,即植入新的抗原受体后的T细胞移植到已荷瘤的NRG或NSG小鼠后,用于临床前评估CAR-T的治疗效果及安全性。例如,表达CD33特异性抗原受体的T细胞治疗白血病可在NSG小鼠上进行临床前治疗评价[4](如图-2)。
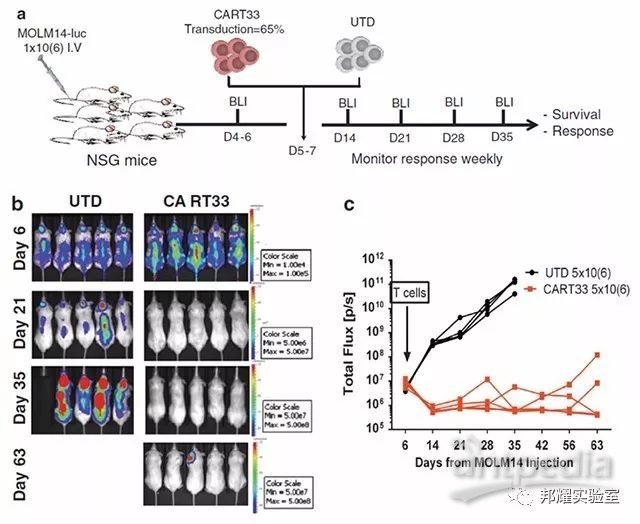
图-2 CART33对荷白血病细胞系在NSG小鼠的治疗效果评价[4]
优化的人源化小鼠(递送人类的细胞因子)
尽管,当前备受瞩目的NRG、NSG小鼠应用广泛,极大推进了生物医学的研究进程。但仍存在较多问题,一个主要因素是小鼠细胞因子与相对应的人的细胞因子交互反应影响人的HSCs,PBMCs的发育和功能。
因此,给人的HSCs,PBMCs一个完整的人的细胞因子的环境,将递送人的细胞因子到NRG或NSG宿主鼠上,使其为人类细胞移植提供一个理想的环境,将会促使NRG或NSG小鼠成为更为理想的临床前动物模型。
例如:SIRPα是表达在巨噬细胞,树突状细胞,造血前体细胞表面受体,它与配体CD47结合激活SIRPα信号通路进而抑制巨噬细胞的吞噬活性,这将阻止细胞表面表达CD47分子细胞被吞噬。
SIRPα高度多态,虽然在NOD背景的小鼠中编码的SIRPα蛋白能与人的CD47结合,进而促使被移植到NRG或NSG小鼠上的细胞通过CD47-SIRPα信号通路逃离吞噬。
然而,非NOD背景的人源化小鼠中,如BRG小鼠,人的CD47 不能与BRG小鼠的SIRPα进行结合,因此,此类人源化小鼠则需要将人的SIRPα替换小鼠SIRPα基因,从而BRG小鼠为人类细胞移植提供一个较为理想的环境,如下图-3。
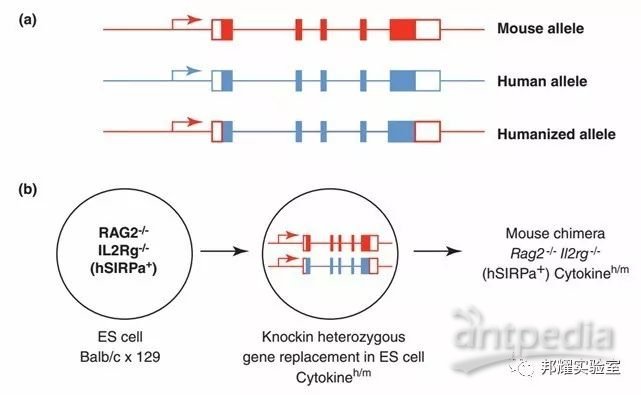
图-3 在BRG小鼠中SIRPα被人的SIRPα基因替换[5]
又如:移植人的CD34+造血干细胞和前体细胞到NRG,NSG小鼠中,虽然能够产生多种类型的造血干细胞,包括T细胞,B细胞,NK细胞,单核细胞,树突细胞,红细胞和血小板。
但是,其中一些细胞系的发育及其功能并不理想。可能原因是人的细胞因子与小鼠的细胞因子相互作用,从而使移植的人的细胞生存及生长受到影响[5]。因此,为人源化小鼠提供更多的人的细胞因子(表-1)将促使当前的NRG,NSG等人源化小鼠更加接近于人的环境。
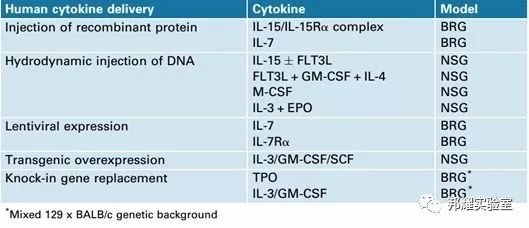
表-1 最优化人源小鼠的一些人的细胞因子[5]
二、表达人基因的人源化小鼠
利用转基因或基因编辑技术构建表达人基因的小鼠。在免疫治疗中,以免疫检查点人源化小鼠最为典型。
因为免疫检查点是人体免疫系统的重要功能性组成部分,可通过升高(激活免疫检查点)或者降低(抑制免疫检查点)免疫信号来调节人体免疫系统,通过靶向免疫检查点进行免疫治疗也成为未来肿瘤治疗中一个新型治疗方法(如图-4)。
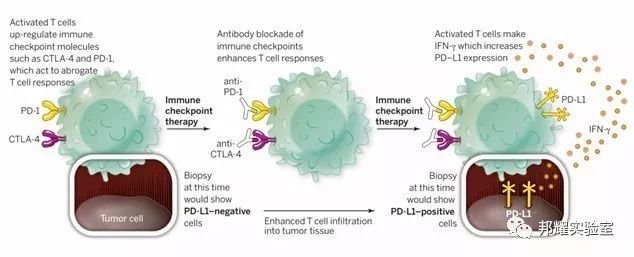
图-4 靶向免疫检查点进行免疫治疗的原理图[6]
基于此,将人的免疫检查点基因替换小鼠相同基因,同时破坏小鼠免疫检查点的基因功能(如PD-1, CTLA4等)制作免疫检查点人源化小鼠。即可将来源于相应遗传背景的小鼠细胞或者组织移植于免疫检查点人源化小鼠上,用于验证人源化抗体的药效的研究。下面详细介绍该类模型,主要包括单个和多个免疫检查点的人源化小鼠。
1. 单个免疫检查点人源化小鼠
这里以PD-1为例,简述hPD-1人源化小鼠的构建[6](上一期我们是以ES打靶技术为大家讲解过h PD-1构建,这次我们讲述基于CRISPR/Cas9 技术的构建过程)如图-5:
(1)首先,对比分析小鼠与人PD-1基因,将人的PD-1胞外结合区替换成小鼠胞外结合区,可将人的2号外显子替换小鼠的2号外显子来实现;
(2)利用CRISPR/Cas9 技术,在2号外显子两侧分别设计sgRNA,并同时构建含有人的序列的打靶载体,共注射受精卵,即可得到PD-1人源化小鼠,同时破坏小鼠PD-1基因。

图-5 PD-1 人源化小鼠的设计方案
2. 多个免疫检查点人源化小鼠
由于免疫反应是多个免疫信号通路相互作用的结果,双免疫检查点人源化小鼠应运而生。如hPD-1 与hCTLA-4小鼠交配即可得到PD-1与CTLA-1双免疫检查点人源化小鼠。多个免疫检查点人源化小鼠则需要构建更多免疫检查点人源化小鼠,之后进行交配。
由于,免疫反应是多个免疫信号通路相互作用的结果,因此,未来多个免疫检查点人源化小鼠,也是研究人源化抗体药物理想的动物模型。目前,比较热门的免疫检查点如图-6。
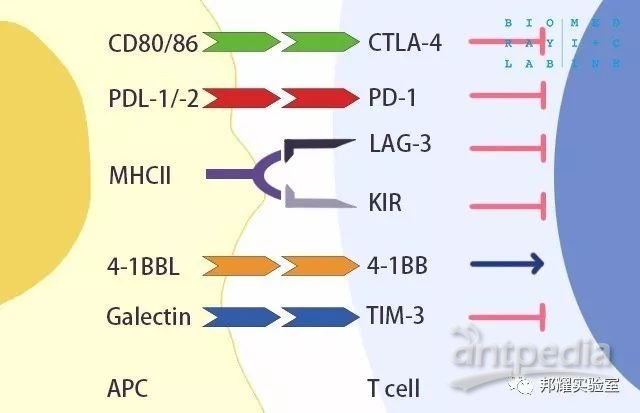
图-6 目前比较热门免疫检查点
小鼠设计注意事项
免疫检查点人源化小鼠构建应与所选择的做实验细胞系遗传背景保持一致,一般选择C57BL/6遗传背景上做基因改造,用相应的遗传背景的细胞系进行做实验。
作基因替换时,一般选择相应基因功能domain 进行替换或者全部替换,其次若基因过长,次选择大小鼠相应基因ATG后敲入人的CDS。无论何种方式,最后均要验证其人的基因表达情况。
3. 免疫检查点人源化小鼠应用
①进行PD-1/PD-L1、CTLA4等免疫检查点阻断的治疗性单克隆抗体或相关化合物的体内给药处理,检测临床前体内人源化抗体药物的筛选与评价。如图-7,人源化的CTLA4小鼠可用于评价人源化抗体K4G4, L1B11,L3D10的抗肿瘤效果。
②与其它免疫检查点人源化小鼠交配成多免疫检查点人源化小鼠,用于临床前体内多个人源化抗体药物联合用药抗肿瘤药效的评价。
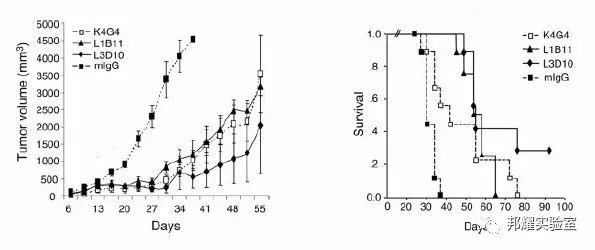
图-7 利用人源化CTLA4小鼠进行人源抗体药物筛选[7]
综上所述,本期我们为大家介绍了肿瘤免疫疗法中的2种重要人源化动物模型:重症联合免疫缺陷小鼠以及人源化免疫检查点小鼠。另外,在研究中发现将CAR-T疗法结合PD-1/PD-L1信号通路阻断可进一步加大肿瘤治疗效果,是免疫治疗的重要发展方向(如图-8)。
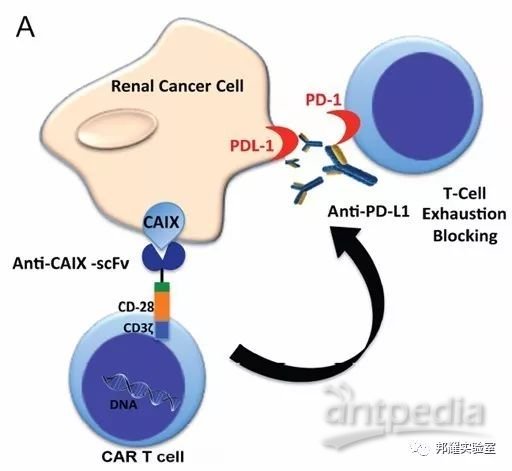
图-8 PD-1/PD-L1阻断与CART组合治疗肾肿瘤[8]
未来随着基因编辑技术在肿瘤免疫疗法领域的应用,以及多种治疗手段与免疫疗法组合的联合治疗方式的出现,对相关动物模型的建立和优化也提出了更高的要求,相信在未来,肿瘤免疫疗法相关动物模型也必将经历一系列的开发和优化过程。
参考文献
[1] Shinkai Y, Lam K-P, Oltz EM, et al. Rag-2-deficient mice lack mature lymphocytes owing to inability to initiate v (d) j rearrangement. Cell, 1992, 68: 855-867
[2] Shultz LD, Brehm MA, Garcia JV, et al. Humanized mice for immune system investigation: Progress, promise and challenges. Nature reviews Immunology, 2012, 12: 786
[3] Shultz LD, Ishikawa F, Greiner DL. Humanized mice in translational biomedical research. Nature reviews Immunology, 2007, 7: 118
[4] Kenderian S, Ruella M, Shestova O, et al. Cd33-specific chimeric antigen receptor t cells exhibit potent preclinical activity against human acute myeloid leukemia. Leukemia, 2015, 29: 1637
[5] Willinger T, Rongvaux A, Strowig T, et al. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends in immunology, 2011, 32: 321-327
[6] Sharma P, Allison JP. The future of immune checkpoint therapy. Science, 2015, 348: 56-61
[7] Lute KD, May KF, Lu P, et al. Human ctla4 knock-in mice unravel the quantitative link between tumor immunity and autoimmunity induced by anti–ctla-4 antibodies. Blood, 2005, 106: 3127-3133
[8] Suarez ER, Chang D-K, Sun J, et al. Chimeric antigen receptor t cells secreting anti-pd-l1 antibodies more effectively regress renal cell carcinoma in a humanized mouse model. Oncotarget, 2016, 7: 34341




















