刘静宇研究组:遗传性痉挛性截瘫致病机制研究新进展
12月20日,Movement Disorders在线发表了题为A Novel SPAST Mutation Results in Spastin Accumulation and Defects in Microtubule Dynamics的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室刘静宇研究组完成。该研究对遗传病家系进行连锁分析和Sanger测序,并结合细胞系模型分析,发现遗传性痉挛性截瘫(HSP)致病基因SPAST编码的截短蛋白质spastin可通过异构体特异性的方式干扰微管的动态平衡,进而导致HSP的发生。研究进一步提出spastin的截短突变体可能通过长期的细胞积累方式影响皮质脊髓束的功能,为探究遗传性痉挛性截瘫4型(SPG4)的致病机制和治疗提供了新方向。
遗传性痉挛性截瘫是遗传和临床异质性神经退行性疾病,其主要特征是下肢进行性痉挛和无力。由SPAST基因突变引起的痉挛性截瘫4型是常见的常染色体显性遗传的HSP亚型。目前,普遍认为该基因突变导致的蛋白质功能丧失引起单倍量不足(haploinsufficiency)是该疾病的致病机制,但该学说未能较好地阐明痉挛性截瘫的临床表型和突变蛋白质功能损伤程度之间的相关性,且相应的临床干预治疗进展较为缓慢。
SPAST基因主要编码M1(68 kDa)和M87(60 kDa)两种异构体并发挥微管剪切活性,维持微管的动态平衡。研究组前期收集了六个自然村的三个大的遗传性痉挛性截瘫家系(247名成员,67名患者)(图1),通过连锁分析将三个家系的致病区段同时定位到SPAST基因座,进一步的Sanger测序证实所有病人均携带SPAST的一个新的插入突变c.985dupA(p.Met329Asnfs*3),该突变产生两种截短异构体dupA-M1和dupA-M87,这两种突变体的蛋白质降解速率降低。同时,研究还发现dupA-M1与微管紧密结合(细胞内纤维状分布),且阻断了微管的解聚过程;而dupA-M87却均匀地分布于胞质与细胞核中,未显示出对微管解聚的干扰(图2A)。
该研究发现SPAST突变导致的spastin截短体可在细胞内长时程积累,或导致高表达spastin的皮质脊髓束及其远端轴突中产生细胞毒性。此外,该研究一定程度上揭示了突变体spastin可能通过异构体特异性的方式影响皮质脊髓束的功能,从而导致遗传性痉挛性截瘫疾病(图2B)。然而,其具体的作用机制有待进一步探索。
研究工作得到国家自然科学基金、科技部、上海市的资助。华中科技大学、湖北省妇幼保健院科研人员参与该工作。
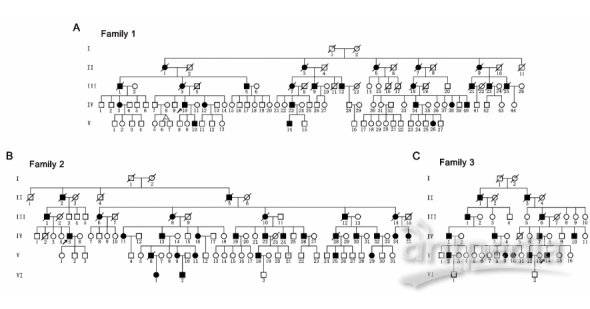
图1.三个来自同一个祖先的常染色体显性遗传的痉挛性截瘫家系系谱
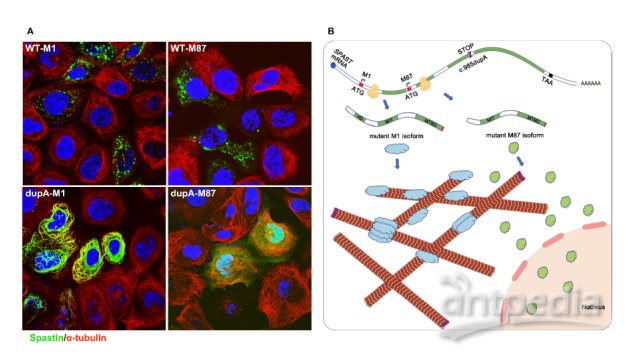
图2.(A)野生型(WT-M1和WT-M87)和截短体(dupA-M1和dupA-M87)蛋白质的细胞定位;(B)spastin突变体c.985dupA(p.Met329Asnfs*3)的致病机制假说