靶向杀灭疟原虫新机制实现,质谱和电镜技术功不可没
8月24日,中国科学院分子植物科学卓越创新中心王四宝团队在《自然-通讯》(Nature Communications)上,在线发表了题为Outer membrane vesicles from a mosquito commensal mediate targeted killing of Plasmodium parasites via the phosphatidylcholine scavenging pathway的研究论文。研究报道了蚊虫肠道共生细菌通过释放的胞外囊泡,利用疟原虫磷脂酰胆碱清除途径,跨界递送抗疟效应分子,实现靶向杀灭疟原虫的全新机制。
疟疾是严重的蚊媒寄生虫传染病,媒介按蚊是传播疟疾的关键环节。抑制病原体在媒介体内的发育和感染是阻控蚊媒疾病传播的新思路。王四宝团队致力于研究蚊虫-肠道共生菌-病原体之间相互作用的分子机理,探究基于肠道共生菌的蚊媒疾病传播阻断控制策略(Symbiont-based transmission blocking strategy,Paratransgenesis)。这种通过“治疗”蚊子以消灭疟疾的方法,为实现源头阻断疟疾等蚊媒疾病的传播提供了新的策略和方法。前期研究发现了具有天然抗疟活性的按蚊肠道共生菌——解脲沙雷氏菌(Serratia ureilytica)Su_YN1,可通过分泌具有裂解疟原虫作用的脂肪酶AmLip,以水平和垂直传播等方式在按蚊种群中快速散播,从而驱动疟蚊抑制疟疾感染传播,这为源头阻断疟原虫感染传播提供了新武器。研究发现,AmLip可进入疟原虫细胞实施靶向杀灭作用,但具体机制尚不清楚。该研究在探究抗疟效应蛋白AmLip如何靶向进入疟原虫的过程中发现,共生菌Su_YN1在吸血蚊虫肠道内产生大量的OMVs(图1a),而AmLip蛋白分泌后并非游离存在,而是倾向与OMV结合形成OMV-AmLip复合物(图1b),从而靶向裂解疟原虫(图1c-e)。
胞外囊泡是细胞间进行物质传递进而实现细胞间通讯的重要途径。外膜囊泡(OMV)是细菌产生的主要胞外囊泡,在细菌细胞间或细菌与宿主细胞之间通讯中扮演着重要角色。然而,科学家对OMV等胞外囊泡如何靶向特定细胞的机制知之甚少,肠道共生细菌产生的OMV能否跨界进入真核病原体亦尚无报道。研究发现,在人和其他哺乳动物等宿主的血液诱导下,共生菌Su_YN1产生大量OMV。这些由血餐诱导产生的OMV含有一些宿主血清脂质成分,尤其是以磷脂酰胆碱(Phosphatidylcholine,PC)为主要特征的血清代谢来源的脂质(图1f)。由于疟原虫丢失了特定的脂质代谢途径,因而必须通过摄取包括PC在内的胞外脂质满足疟原虫的生理代谢需求。因此,富含PC的OMV成为疟原虫摄取的对象。进一步研究发现,富含PC的OMV可通过疟原虫的磷脂酰胆碱清除途径(PC scavenging pathway)被快速、特异地摄取进入疟原虫体内,从而将携带的脂肪酶AmLip转运到疟原虫细胞,实现对疟原虫的特异性靶向杀灭作用(图1g)。
该研究揭示了肠道共生菌如何通过分泌效应蛋白靶向杀灭疟原虫的机制,发现了胞外囊泡在调控吸血媒介昆虫肠道环境中宿主因子-肠道菌-病原体多元跨界互作中具有重要作用(图2),为阻止疟疾传播提供了潜在的创新策略。研究工作得到国家自然科学基金委员会、中国科学院、国家重点研发计划和上海市科学技术委员会等的资助,并获得分子植物卓越中心质谱平台和电镜平台的技术支持。
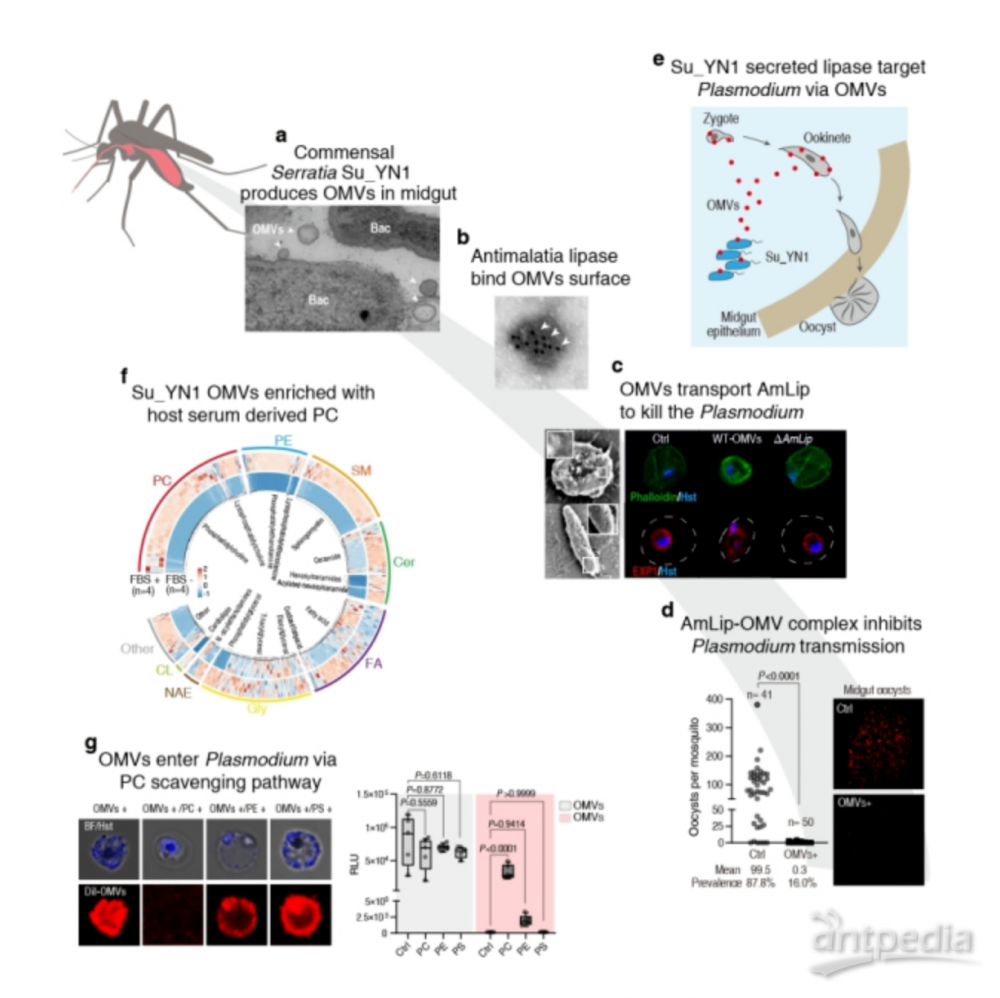
图1.肠道共生细菌利用外膜囊泡转运抗疟效应蛋白AmLip靶向杀灭疟原虫。(a)肠道共生菌解脲沙雷氏菌在吸血按蚊肠道内产生大量的外膜囊泡OMVs;(b)抗疟脂肪酶AmLip分泌后与OMV结合形成AmLip-OMVs复合物;(c)OMVs跨界转运AmLip进入并快速裂解疟原虫;(d)AmLip-OMVs复合物显著抑制按蚊中肠内疟原虫的发育和感染;(e)Su_YN1通过OMVs递送AmLip阻断疟原虫经按蚊传播的示意图;(f)宿主血清诱导Su_YN1产生的OMVs富含大量PC等宿主血清来源的脂质成分;(g)富含PC等脂质的OMVs通过疟原虫PC清除途径被摄取进入疟原虫,实现跨界递送抗疟效应蛋白AmLip靶向杀灭疟原虫。

图2.按蚊肠道共生细菌通过分泌外膜囊泡跨界递送抗疟脂肪酶AmLip靶向杀灭疟原虫的机制示意图
-
科技前沿













